★★★★★★★
- Hibridization : 내가 원하는 전사체가 있느냐
- Southern hybridization : DNA gel 을 membrane에 옮기는 것
- Northern hybridization : RNA gel 을 memebrane에 옮기는 것
- S1 nuclease : DNA와 RNA가 hibridization할 때 인트론 부위를 잘라준다. 단일가닥 부위 DNA를 자른다. (Fig 11.4)
- 전사 개시점 찾는 법
- S1 nuclease mapping
- Primer Extension
- RACE (Rapid Amplification of cDNA Ends)기법
- DNA에 어떤 전사인자가 붙는가?
- EMSA (Electrophoretic Mobility Shift Assay)
- 전기영동 했을 때 이동속도의 변화를 보는 기법
- 늦게 이동하면 단백질이 결합된 DNA
- 빠르게 이동하면 DNA만 있는 부분
- DNase protection
- 전사인자가 얼마나 붙어있는지 보는 것
- DNase1은 전사가 붙어있는 부분은 끊지 못한다.
- DNase 1 footprinting
- 전사인자를 한쪽 끝에만 표지하고 DNase1을 처리한다.
- 몇번째에 있는지 알 수 있다.
- 모티프 서열까지 알 수 있다.
- EMSA (Electrophoretic Mobility Shift Assay)
- Interference Assay
- Motif 서열 찾는 방법
- Reporter gene ****
- 발현량이 증가했는지 감소했는지 알려주는 것
- 유전자의 발현 양상을 똑같이 보여주는 유전자
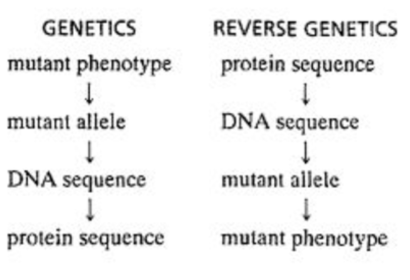
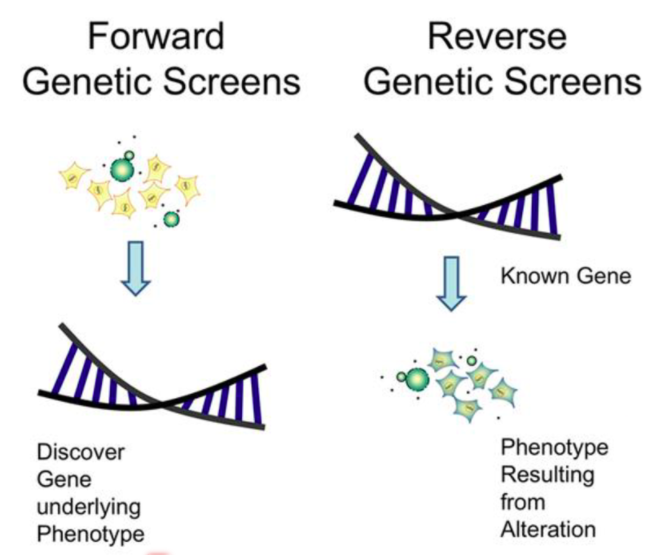
- Forward genetics : 표현형을 보고 어떤 유전자에 의해 생겨났을까 하고 찾는 방법
- Reverse genetics : DNA서열을 먼저 알고 돌연변이를 시킨 후 기능을 아는 것
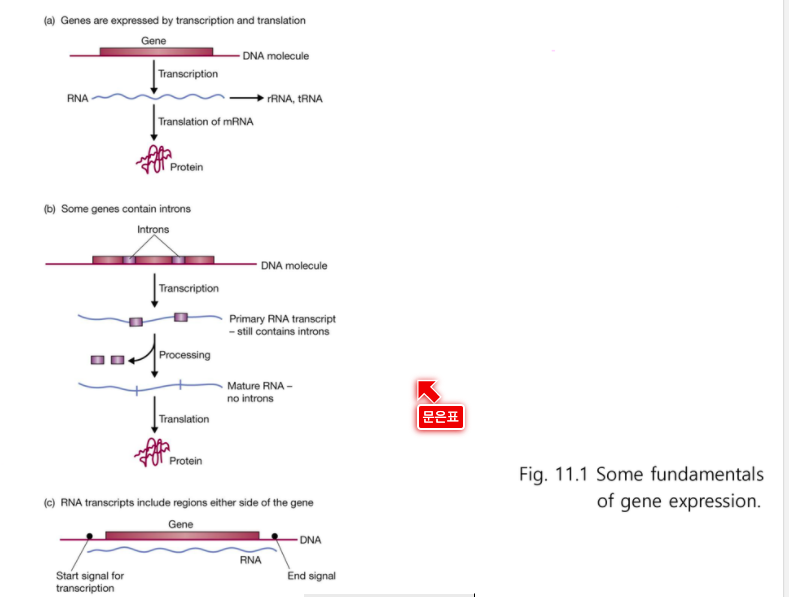
Studying gene expression and function

유전자 발현 정보
rRNA, tRNA를 거쳐 Protein을 만든다.
(c) 개시부위와 종결부위는 살짝 앞쪽과 뒤쪽에 있다.
>> 유전자 발현에 대한 기본적인 단계
Studying the RNA Transcript of the gene
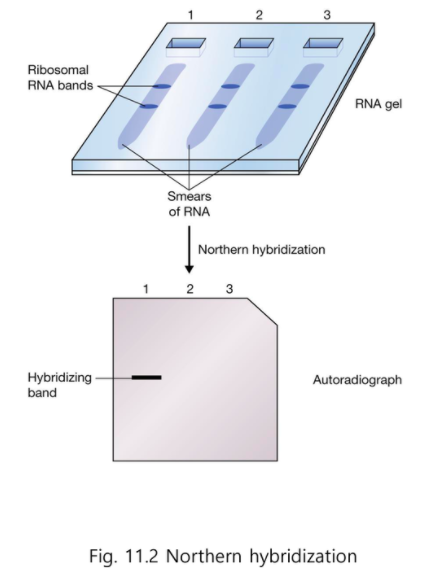
RNA가 특정 조건에서 발현이 되느냐 안되느냐
전사체의 크기에 따라서 자기 위치에 가게 된다.
작은 전사체는 더 빨리내려가고 큰 전사체는 더 느리게 내려간다.
RNA는 유전자에 따라서 길이가 다르기 때문.
Smear 된 RNA
Smear 안에는 사이즈가 다른 전사체들이 있다.
내가 원하는 전사체가 있느냐 : Hybridization
RNA gel은 깨지기 쉽기 때문에 Membrane에 옮긴다.
Southern hybridization : DNA gel을 membrane에 옮기는 것
Northern hybridization : RNA gel을 membrane에 옮기는 것
전사체가 존재하냐 안하냐, 전사체의 크기, 전사량을 알 수 있다.
2,3번에 흐린 것이 나타난다면 전사량을 비교할 수 있다.
전사체의 존재 여부 즉 전사가 됐느냐 안됐느냐, 등을 Northern hybridization으로 알 수 있다.
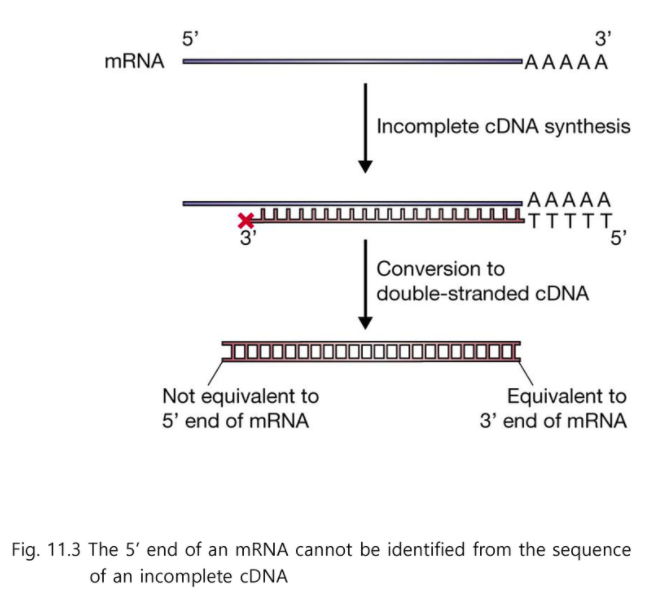
전사 개시점을 찾는 것이 굉장히 중요하다.
전사 개시점을 기본적으로 cDNA 찾을 수 있지만 cDNA로만 알기는 어렵다.
Transcript mapping by hybridization
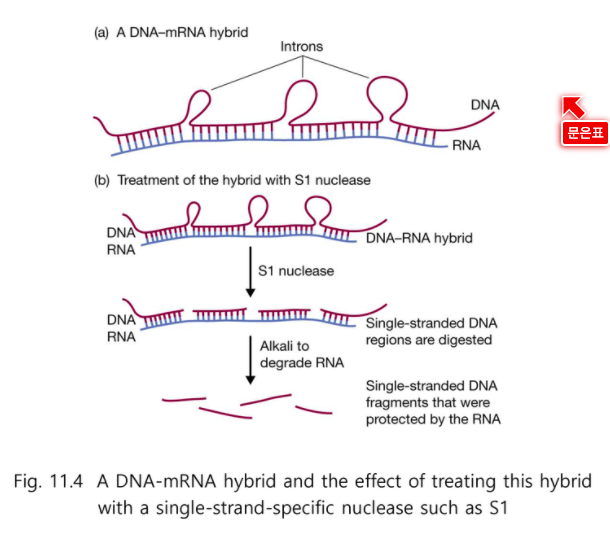
이 유전자에서 실제로 전사되는 부분은 밑부분 RNA이다.
Hybridization 한 부분을 건져서 (전사체 부분을 건져서) (인트론이 이미 삭제된 mRNA)
S1 nuclease로 처리 하면 단일가닥 부위 DNA 만 자른다.
그 후 Alkali로 denaturation 시키면 각 조각이 나온다.
인트론의 크기, 인트론의 갯수 등을 알 수 있다.
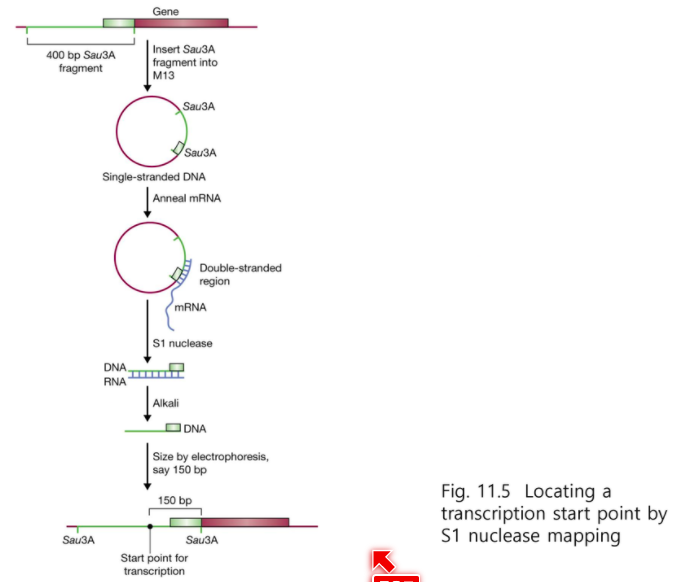
전사 개시점은 앞에까지 완전히 가지 못하기 때문에 다른 방법으로 보완을 해야한다.
그것이 S1 nuclease mapping 이다.
전사 개시점을 알고 싶으면 앞 부분을 넉넉하게 클로닝 해야한다.
여기에 mRNA hybridization 하고
S1 nuclease를 처리하면 단일가닥 부분을 자르고 전사개시점부터 남긴다.
RNA를 제거하기위해 Alkali 처리를 하고 DNA만 남긴다.
이것이 DNA 전사 개시점이다.
전사 개시점, 전사 개시 서열까지 읽을 수 있다.
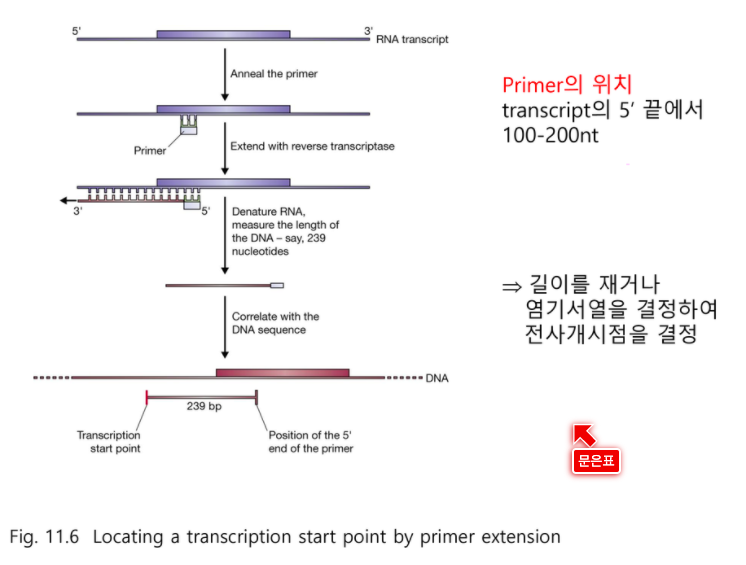
Primer Extension
전사 개시점을 찾아내는 또 다른 방법
끝까지 가기가 어렵기 때문에 앞쪽에 붙인다.
아예 Primer를 중간쯤에 두고 간다.
이것보다 더 많이 사용되는 것이 RACE 기법이다.
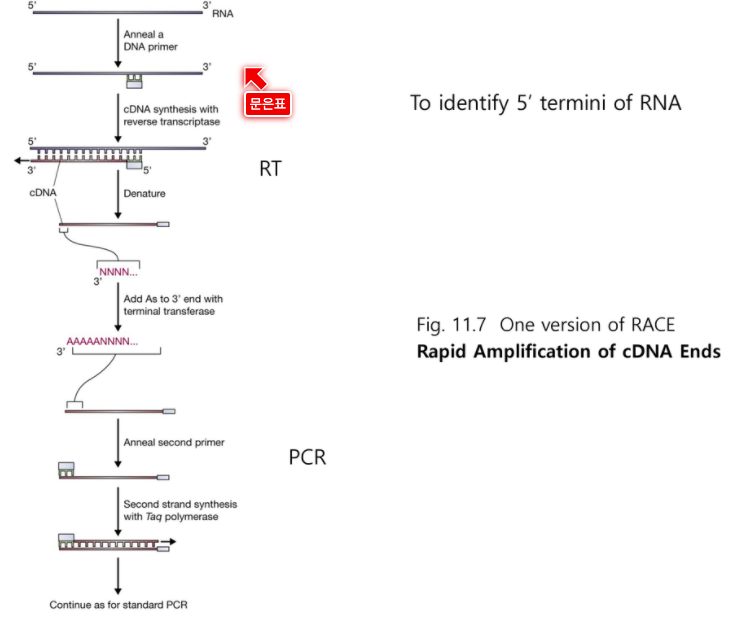
RACE 기법
시작점을 찾기 위한 방법
이것도 프라이머를 중간쯤에 둔다.
합성된 DNA의 끝에 linker를 두고 여기에 붙을 수 있는 프라이머를
RT = Reverse Transcriptation
여기까지 전사체가 있느냐 없느냐 전사 개시점이 어디냐를 보았다.
studying the regulation of gene expression
P207
유전자 발현을 조절하는 조절부위에 대해서 보자
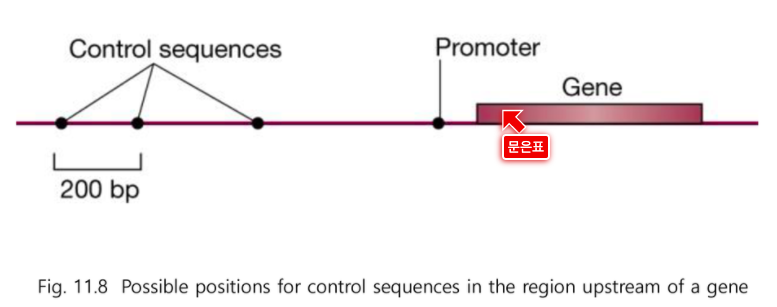
유전자 부위는 개시코돈에서 종결코돈까지를 말한다.
유전자 부위 앞에 조절자가 있다.
Promoter : RNA중합효소가 결합하는 부위
Identifying protein binding sites on a DNA molecule
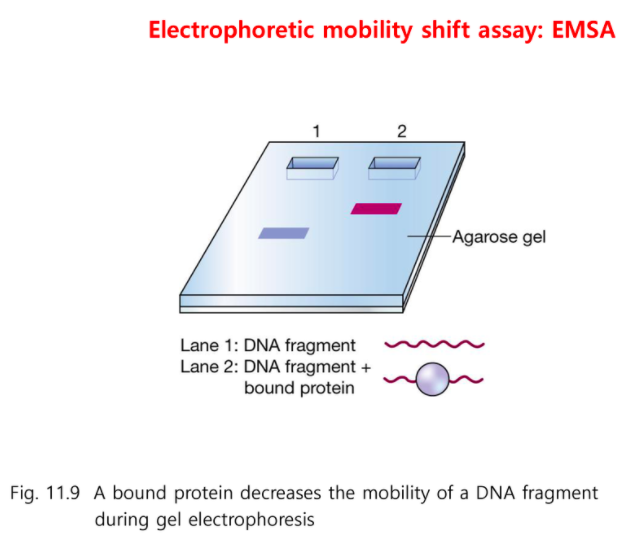
어떤 전사 인자가 결합 하는가?
EMSA 라는 기법을 사용한다.
Electrophoretic Mobility Shift Assay
전기영동을 했을 때 이동속도의 변화를 보는 기법
DNA 조각이 있을 때 전사 조절부위가 있고 전사 조절 부위에 결합하는 전사조절자를 넣어주었다면
이것을 전기영동 하면 단백질에 결합되지 않는 부분은 더 늦게 내려간다.
DNA만 있는 부분은 더 빨리 내려간다.
원래는 gene retardation이라고 불리었다.
늦게 이동하면 단백질이 결합되었다는 뜻이다.
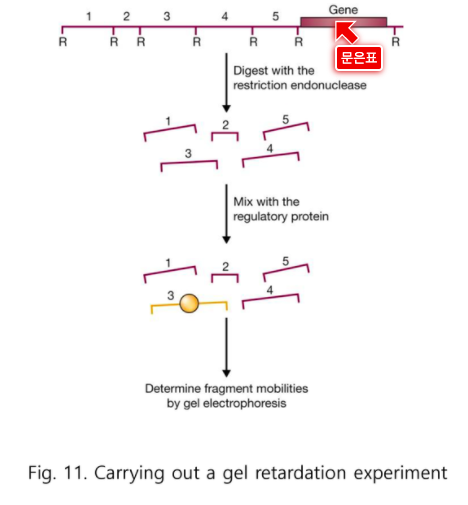
전사 개시 부분 앞쪽을 제한효소로 자른다.
어디에 붙을지가 관심이다.
노란 것은 5개중 어디인가?
전사인자를 넣고 전기영동을 하면 3번 밴드만 위에 걸려있을 것이다.
걸려있는 것을 보고 3번 부분이 있을 것이다 라는 것을 판단할 수 있다.
다만 정확한 서열은 아직 알 수 없다.
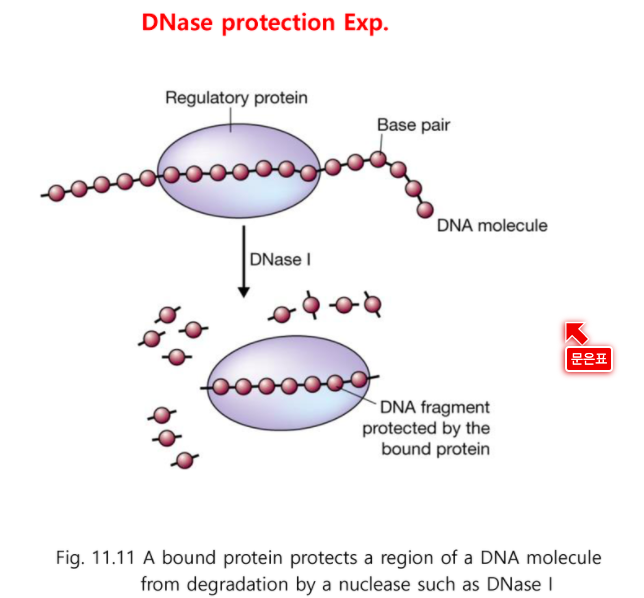
전사 조절자가 얼마만큼 붙어있는지 보는 것
DNase protection Exp.
전사인자를 붙이고 DNase1 을 넣어준다.
DNase1은 DNA를 끊다가 전사인자가 붙어있는 부분은 끊지 못한다.
전사인자가 DNA를 DNase1으로부터 보호하고 있기 때문이다.
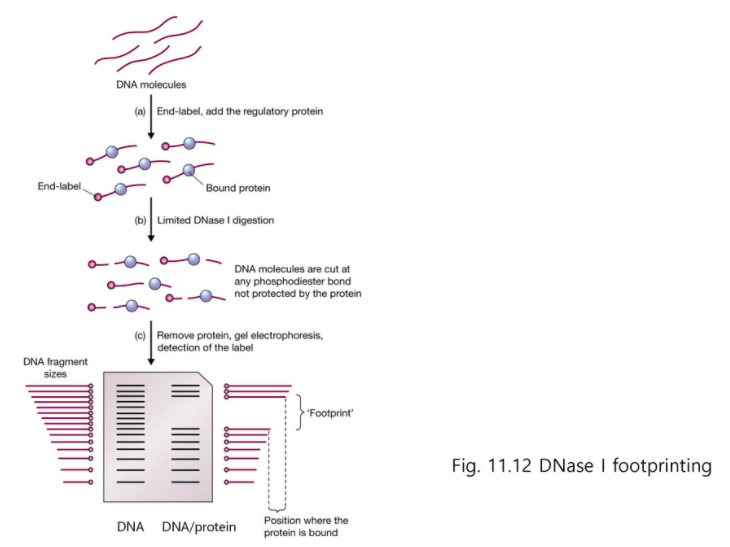
DNase 1 foot printing
한쪽 끝에만 표지하고
DNase1 을 처리한다.
(b) DNase protection과 달리 DNase1을 극소량만 처리한다.
그러면 1,2,3,4,5 번째 중 한군데만 잘리게끔 한다.
(c) 그리고 전기영동을 해보면 모티프 서열까지 알 수 있게 된다.
몇번째에 있는지를 알 수 있다.
실제로 전사인자가 contact하는 부위는 그렇게 길지 않다.
다른 부분은 공간적으로 그냥 있는 것이다.
보통 전사인자가 결합하는 핵심 모티프는 6~8개 이다.
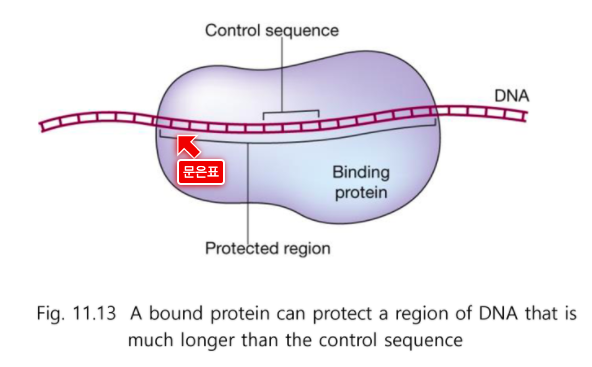
실제 Control sequence는 길지 않다. 이것이 motif이다.
motif까지 알고 싶다면 interference assay
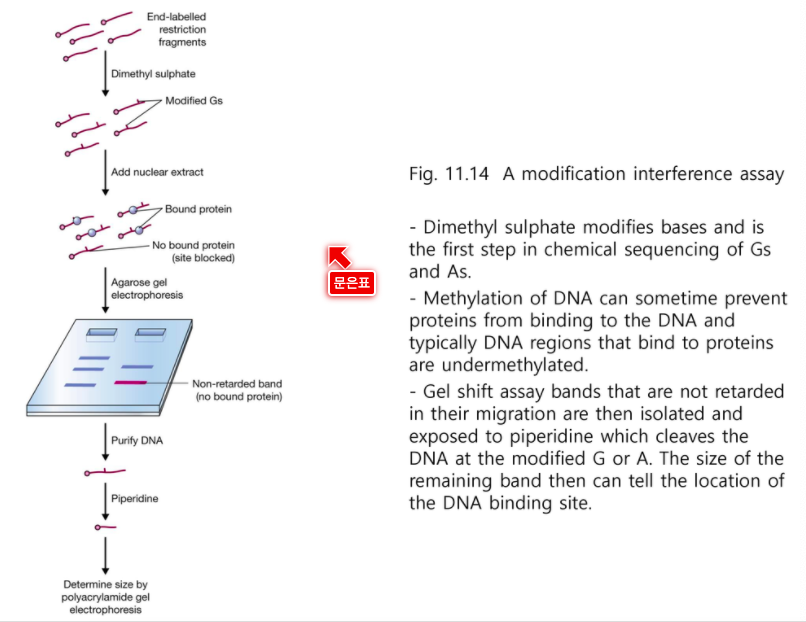
Interference Assay
Motif 서열을 찾는 방법
DMS를 적은양을 처리한다. 각 조각당 한번만 반응하도록 처리한다.
그 후 전사인자를 붙인다.
그러면 metilation 부분이 중요한 부분이 아니다 싶으면 전사인자는 붙는다.
중요한 부분이라면 전사인자가 붙지 않는다.
그 후 전기영동을 해보면 빨리내려간 부분이 motif이다.
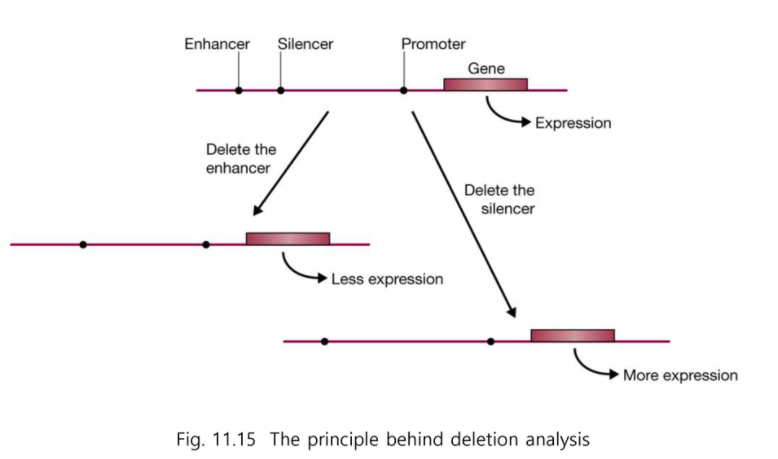
전사 조절자는 Enhancer 역할 하는 것이 있고 Silencer 역할 하는 것이 있다.
Enhancer와 Silencer는 조절 부위이다.
우리가 알아낸 전사조절자가 무슨 역할을 하는지 알려면 Deletion analysis를 하면 알 수 있다.
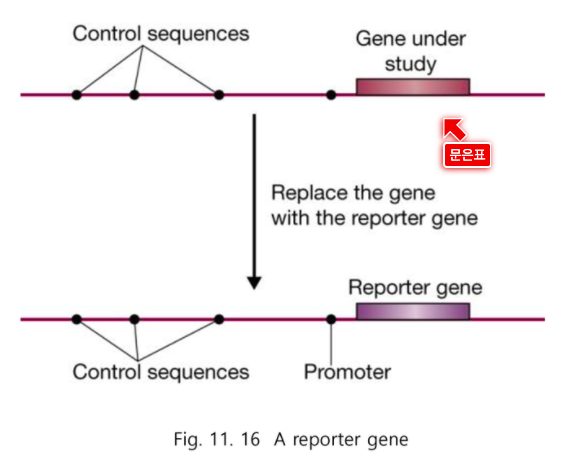
Reporter gene ****
: 발현량이 증가했는지 감소했는지 알려주는 것
내 유전자 대신 보고 해주는 유전자
내 유전자의 발현양상을 똑같이 보여주는 유전자이다.
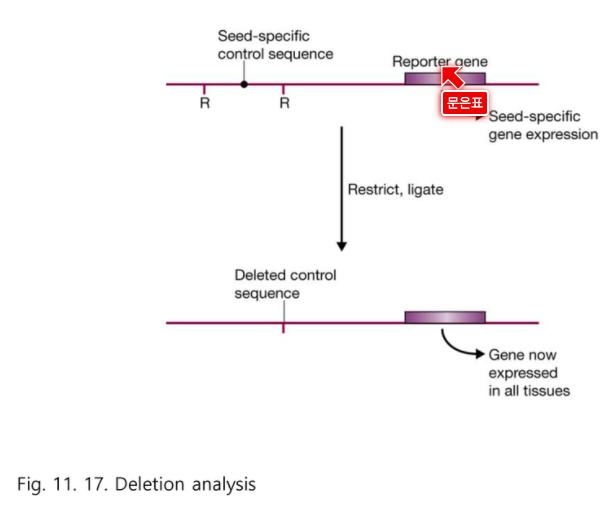
내가 관심있는 유전자 대신에 쉽게 알려주는 것이 Reporter gene
리포터 유전자를 붙이고 deletion 한다.
그리고 전사 조절자 부위를 삭제해보면
그 부위가 어떤 기능을 하는지 알 수 있다.

GFP가 가장 잘 쓰인다.
이제 단백질을 분석해보자
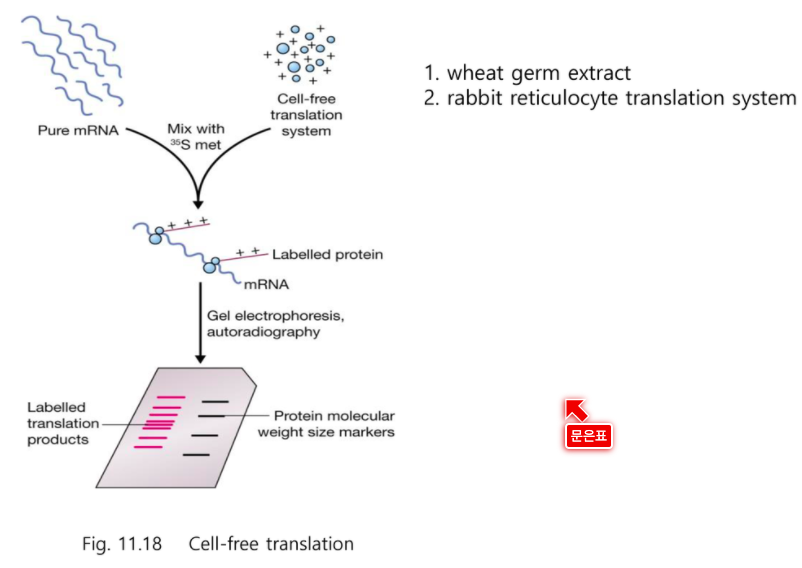
동위원소 표지된 메티오닌을 써서 (AUG)
메신저 RNA
이때 번역된 단백질들은 쉽게 동위원소로 가시화할 수 있다.
mRNA가 다양하다면 다양한 밴드가 나올 것이다.
사이즈 크기로 내가 원하는 mRNA가 나왔는지 알 수 있다.
HART, HRT는 생략
11.19 11.20
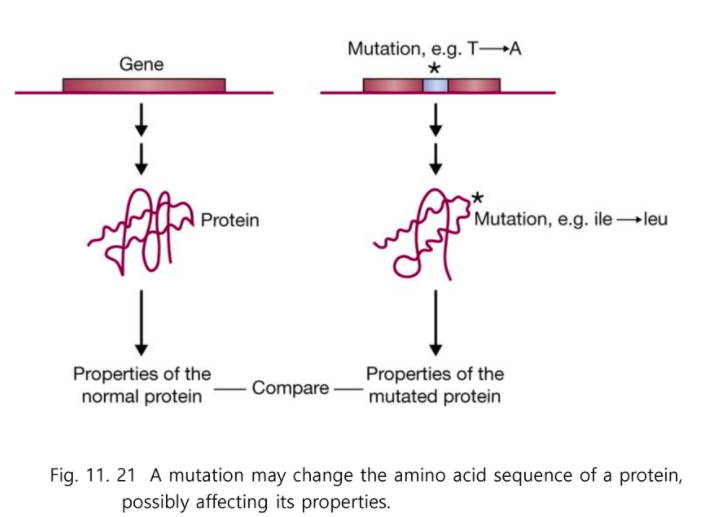
단백질에 대한 연구를 하기 위해서 돌연변이를 시켜본다.
단백질에는 functional domain이 있다.
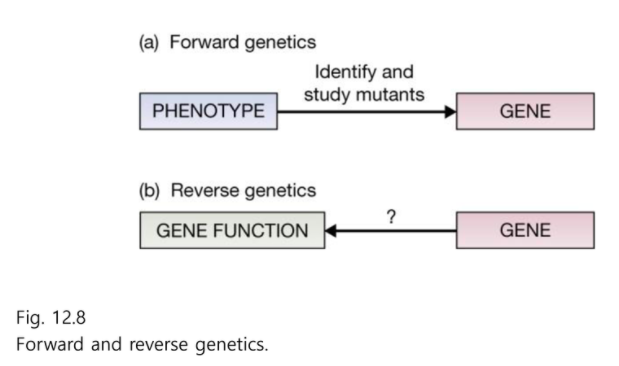
Forward genetics :
표현형을 보고 빨간눈은 어떤 유전자에 의해서 생겨났을까 찾는 법
Reverse genetics :
DNA서열을 먼저 알고 돌연변이를 시킨 후 기능을 아는 것
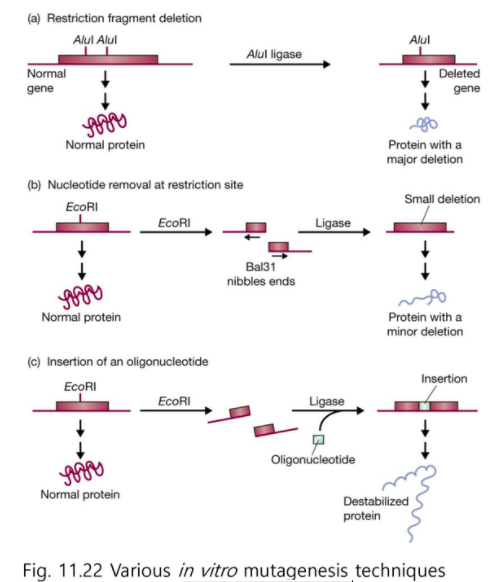
돌연변이를 시켜 보는 것이 유전자가 무슨 기능을 하는지 아는데에 중요하다.
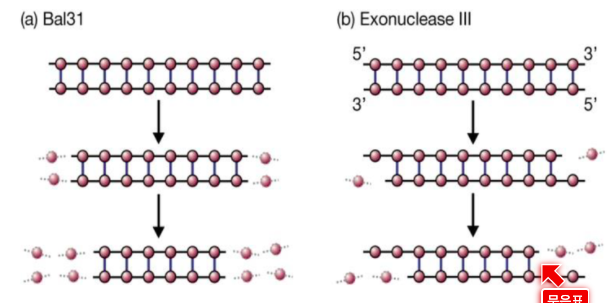
Exo 3 : 3’ 쪽만 자른다
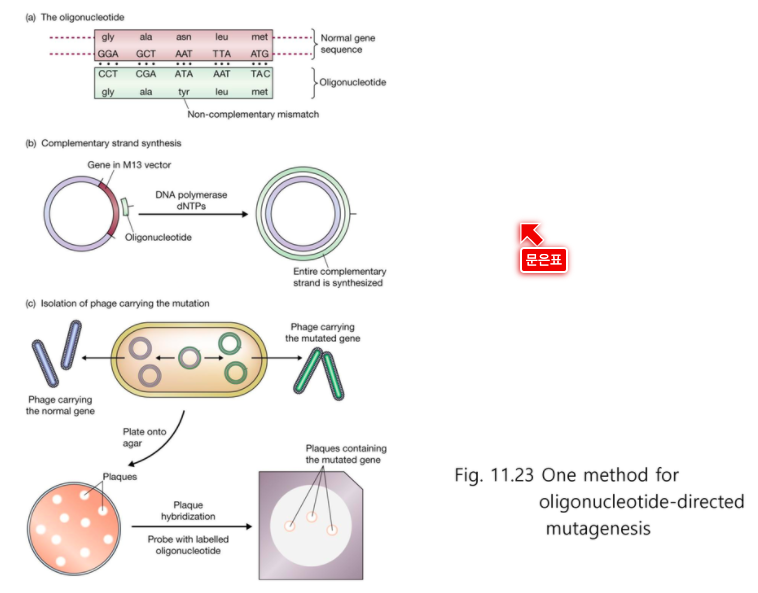
자리 특이적 돌연변이
(a) DNA부위의 맞은 편에 Oligonucleotide 가 있다.
AAT 를 TAT로
(b) 바꾼 것을 벡터에 넣고 (클로닝 하고)
(c) 넣어줘서 돌연변이를 확인한다.
올리고뉴클레오티드는
Mutation을 넣을 수 있고
Primer 역할을 할 수있다. 시발점 역할. Mutation을 유발하는 Primer
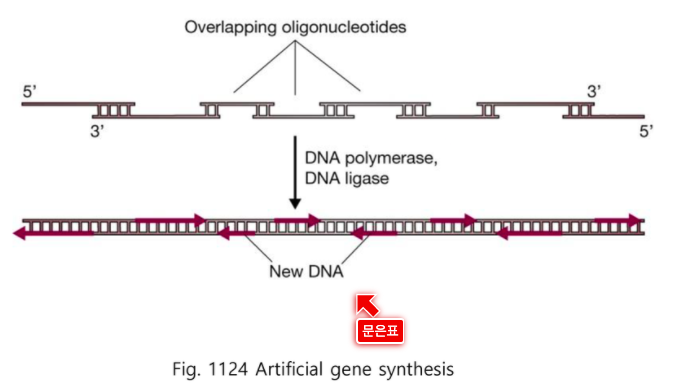
굳이 M13을 만들지 않아도 된다.
짧은 조각들을 만들고 Overlapping 되게 하여
중합효소와 Ligase를 넣어준다.
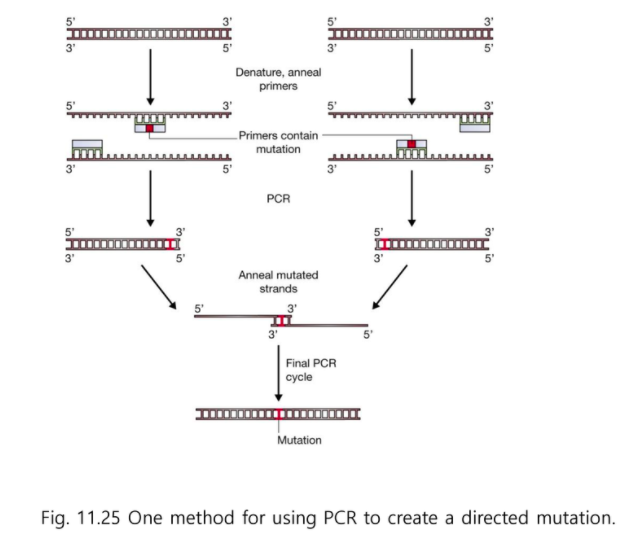
PCR을 돌려서 overlap 되게 한다.
PCR을 통한 mutation 도입 법
돌연변이가 일어난 유전자를 다량으로 증폭할 수 있다.
'🧬 Bio > 유전공학' 카테고리의 다른 글
| 유전공학 12장 (2) - Proteomics (0) | 2020.05.18 |
|---|---|
| 유전공학 12장 - Studying Genome (0) | 2020.05.07 |
| 유전공학 10장 - Next Generation Sequencing (2) (0) | 2020.04.27 |
| 유전공학 10장 - Next Generation Sequencing (0) | 2020.04.23 |
| 유전공학 9장 - 중합효소 연쇄 반응(PCR:The polymerase chain reaction) (0) | 2020.04.20 |