- 코로나 바이러스
- ACE2 : angiotensin 자르는 효소, 코로나의 수용체 역할 하는 단백질
- 스파이크 단백질
- 당단백질
- sugar chain : 인체의 면역시스템 피해가는 기작
- ACE2 의 binding interface에 붙는다.
- ACE2 와 binding 일어나는 부위 : 스파이크 단백질의 윗부분
- 원형질막과 융합이 일어나는 부위 : 스파이크 단백질의 뿌리부분
- 인플루엔자 바이러스
- 외피 O
- single strand RNA가 분절되어 있다 = 분절유전체
- single strand RNA를 나선형캡시드가 감싸고 있다.
- 나선형캡시드 -> 유연성이 높다 -> 형태다형성
- 스파이크 단백질 2가지
- 헤마글루티닌 (H) : 적혈구 응집소 : 적혈구를 응집시킬 수 있다. (항원-항체)
- 시알산 결합시키는 단백질
- 세포에 들어갈 때 필요하다.
- 뉴라미니데이스 (N)
- 시알산 분해하는 단백질
- 세포에서 방출될 때 필요하다.
- 기질 단백질 (M) : 외피 안쪽에 있다.
- ( H,N ( M ( 나선형캡시드) M ) H,N ) 구조
- 헤마글루티닌 (H) : 적혈구 응집소 : 적혈구를 응집시킬 수 있다. (항원-항체)
- 아데노 바이러스
- 외피 X
- 정이십면체 뉴클레오캡시드
- 캡시드 스파이크 O (스파이크 단백질 X) : binding 할 때

표면의 스파이크단백질이 중요한 역할을 한다.

ACE2 라는 단백질이 있다.
ACE2 를 풀어쓰면 angiotensin 을 자르는 효소이다. 펩타이드성 분해효소
이 단백질이 이번에 겪고 있는 신종 코로나의 수용체 역할을 하는 단백질이다.
사스와 신종코로나는 굉장히 유사하기 때문에 ACE2에 흡착이 되고 인체세포의 세포막에 존재하는 수용체이다.
옛날 사스와 지금 코로나는 유사하지만 친화도가 다르다.
코로나의 스파이크 프로틴이 사스보다 친화도가 5배가 크다.
그래서 감염도가 높다.
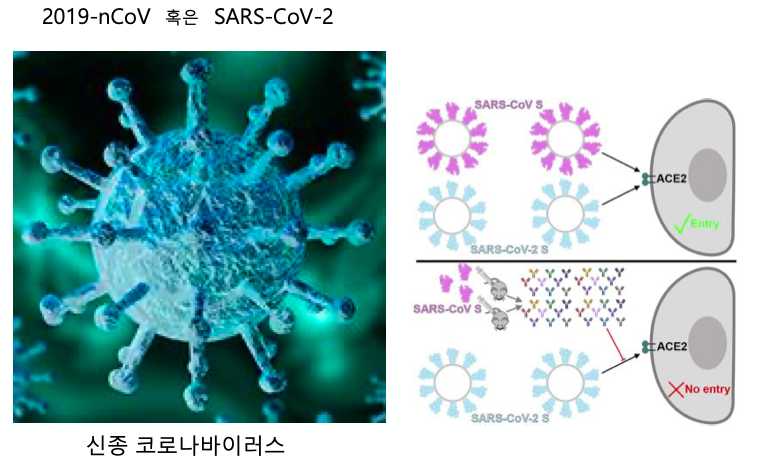
옛날 사스 바이러스는 쥐에 찔러서 항체를 만들어서 막았다.
옛날 스파이크 프로틴에 대한 항체가 코로나의 스파이크도 인지할 수 있지 않느냐?
그러나 인체에 적용하기에는 아직 무리가 있다. 실험적으로는 얼마든지 도움이 된다.

ACE2의 발현량을 비교해 본 것.
폐에서의 ACE2의 발현량이 굉장히 적다.
이것은 무엇을 의미하나?
폐에서 ACE2의 발현량이 높다면 폐에 데미지가 크다고 설명이 가능한데, 발현량이 낮는데 데미지가 크다?
시간이 가면 폐에서 다른 조직으로 전파가 되면서, 밑으로 내려가면서 소장이나 대장 십이지장에도 침투하면서 전파될 것이라는 것을 간접적으로 암시하고 있다.

스파이크 단백질의 3차원 구조가 어떤 모습이냐?
신종 코로나의 스파이크 프로틴은 어떻게 관찰이 되느냐
옆에서 보면 삼각뿔 모양이다. 위에서 보면 정삼각형이다.
ACE2의 수용체에 가서 붙어야 한다.
가운데 부분이 binding과 관련이 높다.
closed된 상태로 존재한다.
binding할 때에는 열린 형태로 바뀐다.
open 되면서 붙어 있어야 될 팔이 솟아 오른다. (흰색 부분)
포개져야 하는데 발딱 선다. 솟아 오르게 된다.
이게 열린 상태이다.

닫힌 상태에서는 그냥 있는데, 열린 상태에서는 솟아 오른다.

스파이크 프로틴은 당단백질이다.
그러면 당이 붙어있을 때에는 모양이 어떻냐?
hACE2에 binding한다. 휴먼ACE2
당단백질이란 protein에 sugar chain이 붙어있는 것이다.
그런데 스파이크 프로틴은 코로나 바이러스의 당 단백질이다.
인간 수용체에 있는게 ACE2이고 여기에 붙어서 인체 세포 속으로 들어간다.
이 바인딩을 할 때 역할을 하게 된다.
sugar chain이 어떤 역할을 하느냐? 는 결과가 나와봐야 알 수 있다.
왜 sugar chain이 덮고 있느냐?
인체의 면역 시스템을 피하게 하는 기작이다.
바이러스가 체내에 들어와서 면역 작용을 피해가는 기작이다.

어떻게 붙는지를 보여주는 그림이다.
C를 보면 접착점이 있다.
전체 아미노산 중 접착점( binding interface )에 직접 붙는 애들이 중요하다.

솟아 오르면서 binding이 되면서 바이러스가 세포안으로 들어가게 된다.
왜 옛날의 싸스 바이러스는 같은 ACE2에 붙는데, 지금 신종코로나보다 5배나 친화도가 낮을까?
아미노산에 돌연변이가 일어난게 아닐까?
조사해본 결과 스파이크 프로틴의 아미노산의 다른 아미노산으로 change가 되어있는 것이다.
훨씬 더 잘 붙도록 아미노산이 바껴서 binding affinity가 높아졌다.
ACE2와 스파이크 단백질이 붙는 것을 막으면 참 좋겠다.
스파이크 프로틴의 또 다른 특징중 하나
: 삼각뿔의 밑부분(줄기 부분)은 host세포로 들어갈 때 세포막 융합이 일어나는 부분이다.
★★★★★★★
- 수용체의 binding : 윗 부분
- 원형질막 융합 : 뿌리 부분


인플루엔자 바이러스

외피가 있다.
인플루엔자 바이러스는 외피가 있고, 외피 안의 캡시드는 나선형 캡시드이다. ★★★★★★★
single strand
RNA가 분절된 체로 가지고 있다
ssRNA가 하나가 아니고 7~8개로 분절되어 있는 분절유전체(segmented genome)이다
그럼 그 분절유전체를 캡시드가 다 감싸야 한다.
굉장히 스파이크 프로틴이 촘촘하다.
이것도 굉장히 중요한 하나의 포인트이다.
TNV바이러스는 경직성을 갖지만 인플루엔자바이러스는 유연성을 갖는다.
이 나선형 캡시드를 형성했을 때 유연성이 있어서 형태가 다양하다.

헤마글루티닌(Hemagglutinin) : 적혈구 응집소 : 적혈구를 응집시킬 수 있다. ★★★★★★★
적혈구 표면에 있는 분자를 인식할 수 있다. 마치 항체가 항원을 응집시키는 것처럼
뉴라미니데이스(Neuraminidase) ★★★★★★★

인풀루엔자 바이러스의 가장 중요한 스파이크 프로틴 2가지 ★★★★★★★
- 헤마글루티닌 (H 하나만 써도 된다)
: 시알산을 결합시키는 단백질이다. sialic 에서도 binding 프로틴이다.
인체에 들어갈 때 기도와 코를 통해 들어간다. 전적으로
처음 들어갈 때 세포막 표면에 존재하는 sialic acid가 존재하면 다~ 붙을 수 있다. 시알산 결합 능력이 있다.
H 는 들어갈때 필요하다. - 뉴라미니데이즈 (N 하나만 써도 된다)
: 시알산을 분해하는 효소이다.
바이러스가 다 만들어지고 세포에서 방출이 될 때 이 효소가 작용을 해야 방출이 된다.
N 은 방출될때 필요하다.
외피에 존재하는 스파이크는 2종류이다.
H는 하나만 있는게 아니고 variation이 있다. H1 ~ H16
인플루엔자 바이러스는 지놈이 자꾸 바뀐다.
백신은 잡을수 있는 것만 잡지, 유전자 변형이 일어난 것은 무효화 된다.
N은 N1 ~ N9 까지 있다.
진단을 하려면 적어도 144가지의 타입이 있어야 한다. 16*9=144
항상 변해서 이 바이러스에 대한 백신은 큰 성공을 이루기 힘들다.
외피 안쪽에는 뉴클레오캡시드가 있다. 뉴클레오캡시드라는게 뭐냐?
핵산 RNA에 RNA binding protein이 있다. 핵산 표면을 단백질이 쭉 둘러싼다. 나선형으로
실제로 이런게 인플루엔자 바이러스는 7개 정도 있는데 이게 다 모여야 한다.
외피 막에 H와 N이 쭉 꽂혀있고 바로 밑에 하나의 층이 더있다.
이게 바로 M이다.
M은 기질 단백질이다. 외피 안쪽이다.
M이라는 것이 막에 탁 붙어있다.
뉴클레오캡시드가 모이면 내피쪽에 M이 두르고 외피에는 H와 N이 둘러싸면서 방출이 된다.
( H,N ( M ( 나선형캡시드 ) M ) H,N )
아데노 바이러스

아데노바이러스는 정이십면체이다. 아주 독보적인 존재이다.
이 바이러스는 캡소머가 5~6개의 프로토머로 구성되며
캡소머들이 면을 차지하고 있다. (a) 똥그라미 작은 것들
스파이크 단백질처럼 섬유가 달려있다. 이 부분도 바인딩할 때 중요하다.
아데노바이러스는 외피가 없는 구조이다. 막이 없다.
정이십면체 뉴클레오캡시드 only이다. ★★★★★★★

외피가 보이지 않고 캡시드만 있는 채로 스파이크가 보인다. >> 캡시드 스파이크
원래 외피에 스파이크가 있지만 아데노바이러스는 아니다.
아데노바이러스는 캡시드 스파이크를 가지고 있다. ★★★★★★★
스파이크 프로틴 X

접할 때의 접점이 캡시드 스파이크다.
최초의 contactor : 수용체 <-> 스파이크
'🧬 Bio > 미생물학' 카테고리의 다른 글
| 미생물학 4장 (4) - 용균성, 용원성 (1) | 2020.04.17 |
|---|---|
| 미생물학 4장 (3) - 박테리오페이즈 (0) | 2020.04.15 |
| 미생물학 4장 (1) - 바이러스의 구조 (0) | 2020.04.08 |
| 미생물학 3장 (2) - 진핵세포의 세포내흡입 (0) | 2020.04.03 |
| 미생물학 3장 (1) - 진핵세포의 구조 (0) | 2020.04.01 |