
DNA 활성화 영역


ChIP (chromatin immunoprecipitation)
chromatin = DNA + 단백질 복합체

우선, DNA와 DNA 결합 단백질을 결합시키는데, 살아있는 세포를 그냥 두면 단백질이 DNA에 붙었다가 곧 자기 할 일을 마치고 떨어진다.
따라서 폼알데하이드를 이용하여 세포를 고정시켜 DNA와 단백질의 결합을 유지하도록 한다.
이후, 초음파나 효소 따위를 이용하여 세포를 부수고 DNA를 200~300bp 정도 크기로 잘게 쪼갠다.
이 과정이 끝났다면 우리가 찾고자 하는 단백질에 대한 단일 클론 항체를 넣어 반응시키면, 항원-항체 응집반응이 일어나 우리가 목표로 하는 DNA들이 바닥에 침강하게 된다.
여기에 열을 가하면 DNA와 단백질의 결합이 풀리며 단백질과 항체는 함께 떨어져 나가고 원심분리를 통해 DNA만 분리할 수 있다.
분리한 DNA를 PCR을 통해 증폭시켜 서열 분석을 하면 어떤 서열인지 알 수 있을 것이고, 전체 DNA 서열과 대조하여 어느 위치에 있는지 알 수 있다.
그러나 이 방법의 단점은, 하나의 조절인자(단백질)이 반드시 하나의 결합부위에만 결합하는 것은 아니라는 점이다.
어떤 조절인자들은 비교적 광범위한 유전자를 조절할 수 있으며, 다른 조절인자와의 상호작용을 통해 DNA에 결합하기도 한다.
또 서열 비특이적 결합을 하는 어떤 조절인자들의 경우에는 이 방법을 통해 서열을 분석하기가 비교적 곤란하다는 문제도 발생한다.
(주로 주변서열에 결합하는 다른 조절인자의 보조를 받아 결합하는 경우가 많기 때문이다)
하지만 그럼에도 불구하고 현재 연구된 많은 조절인자들의 DNA 결합부위는 이 방법을 이용하여 밝혀낸 것들이 많으며, 아직도 유용한 분석 방법이다.

Activator의 전사 활성화 기작 1

Activator의 전사 활성화 기작2

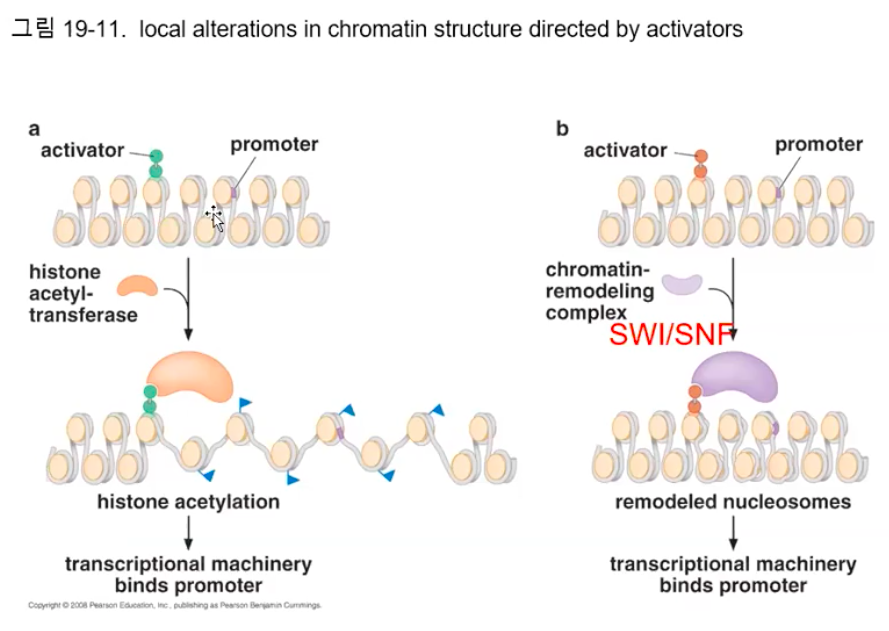
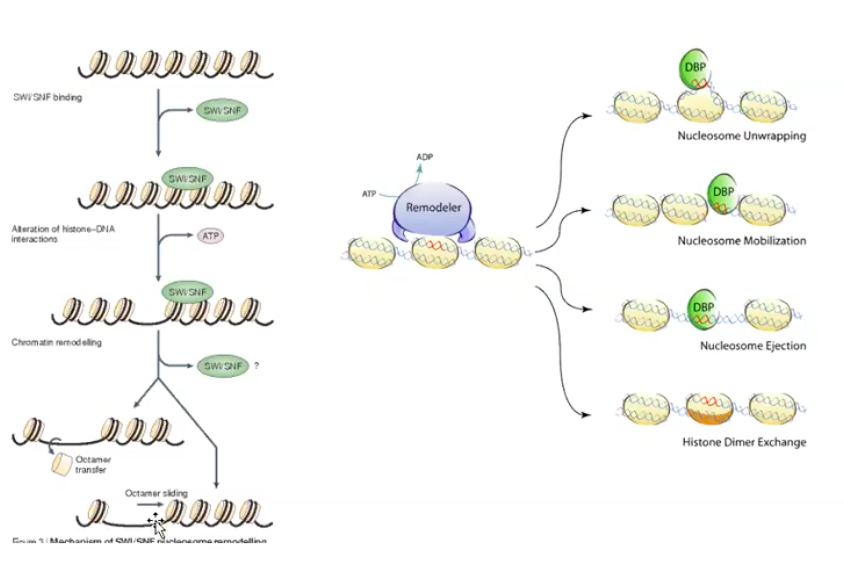
느슨한 부분으로 만들면 그 부분이 활성화 영역이 된다.
응축 = 불활성화
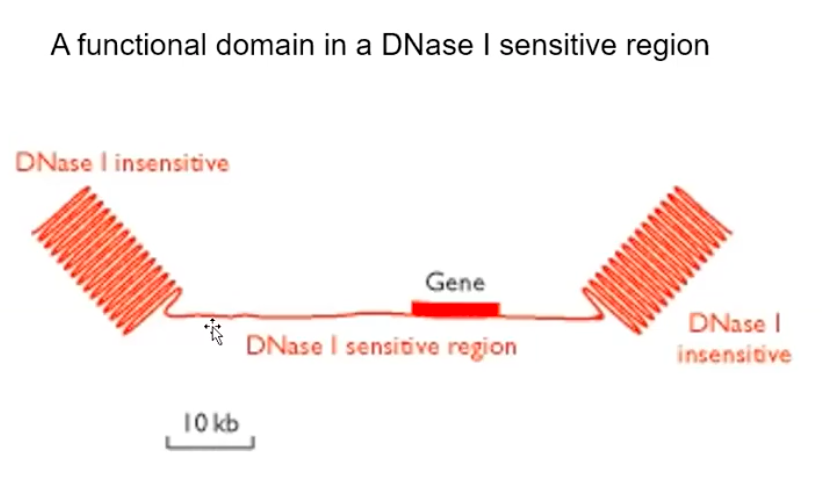
DNase1 처리를 하면 느슨한 부분은 잘려서 어느 부분이 활성화 영역인지 알 수 있다.
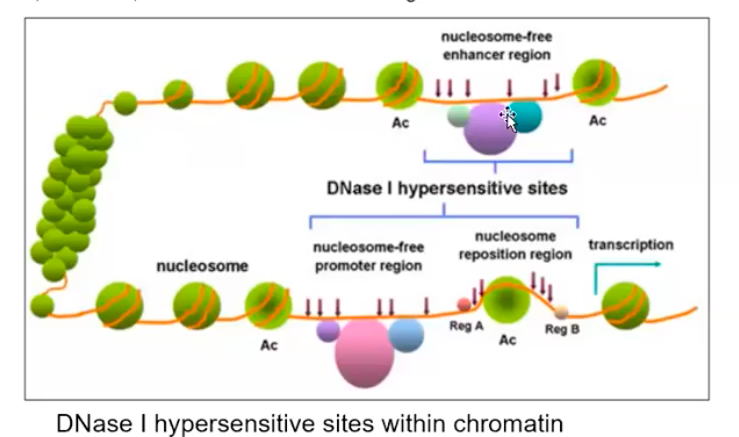
이렇게 만드는 것이 전사활성자 역할이다.
Activator의 전사 활성화 기작 3

Activator의 전사 활성화 기작 4

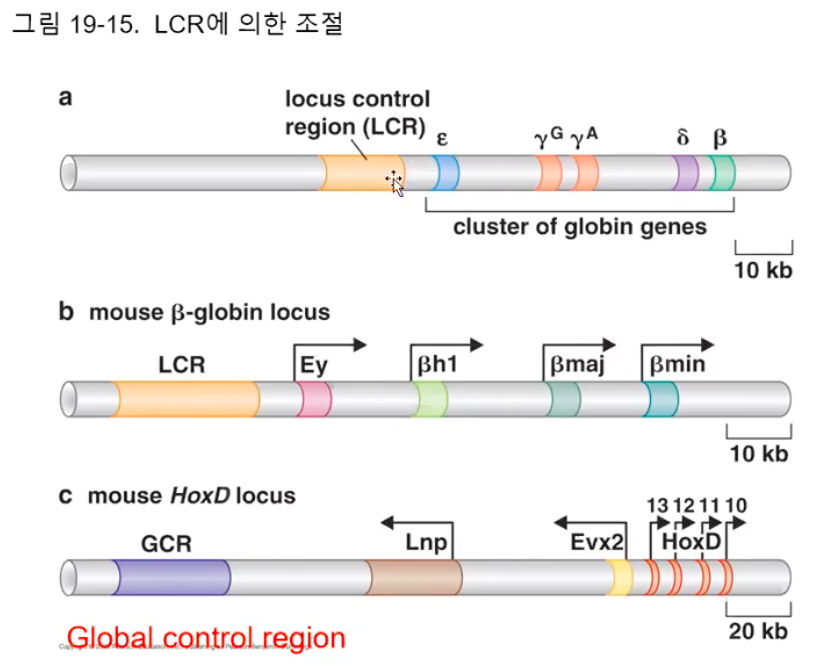
Activator의 전사 활성화 기작5 : LCR

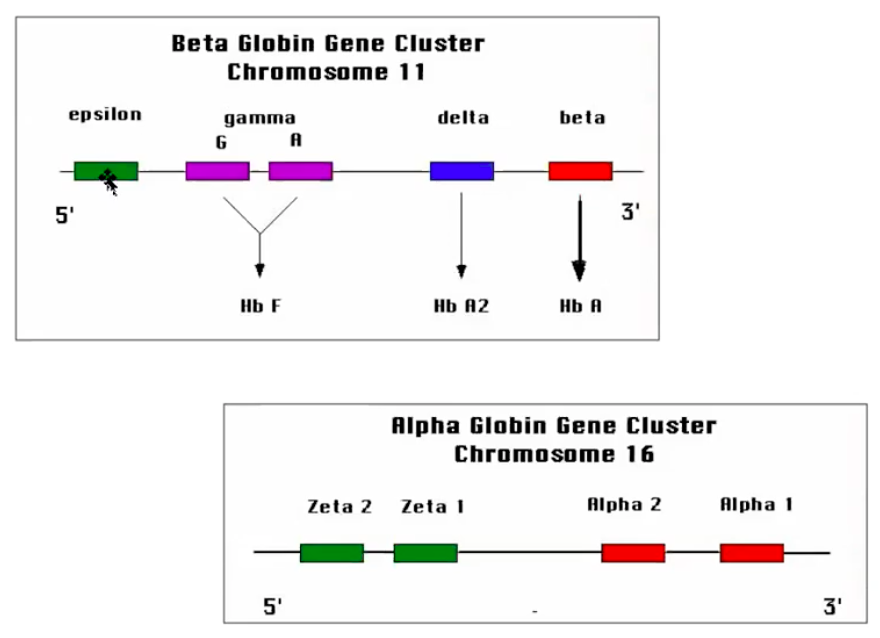
어떤 유전자군(Gene clusters)은 일군의 조절 서열에 의해 발현이 통제되는데, 인간 글로빈(Globin) 유전자의 예를 살펴보자.
사람에게는 다섯 종류의 글로빈 유전자가 존재하는데 이 유전자가 동시에 발현되지 않는다.
(3' 말단부터 ε, γG, γA, δ, β의 순서를 갖는다)
서로 다른 유전자들이 발달 단계에서 ε부터 β의 순서대로 발현된다. 만약 인위적으로 유전자를 바꿀 경우, 바꾼 순서대로 발현된다.
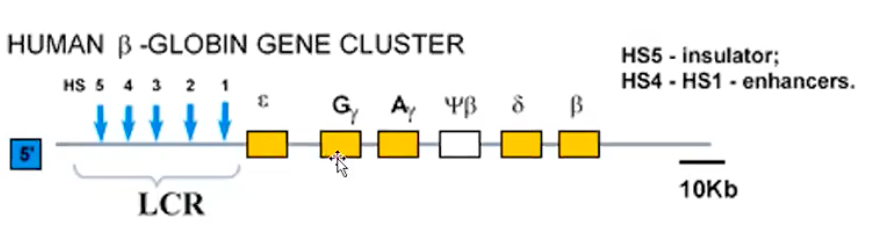
이 유전자군을 통제하는 조절 서열은 상류에 위치한 자리 조절 부위(LCR, Locus control region)라 불리는 여러 조절 서열들이 모인 긴 부위다.
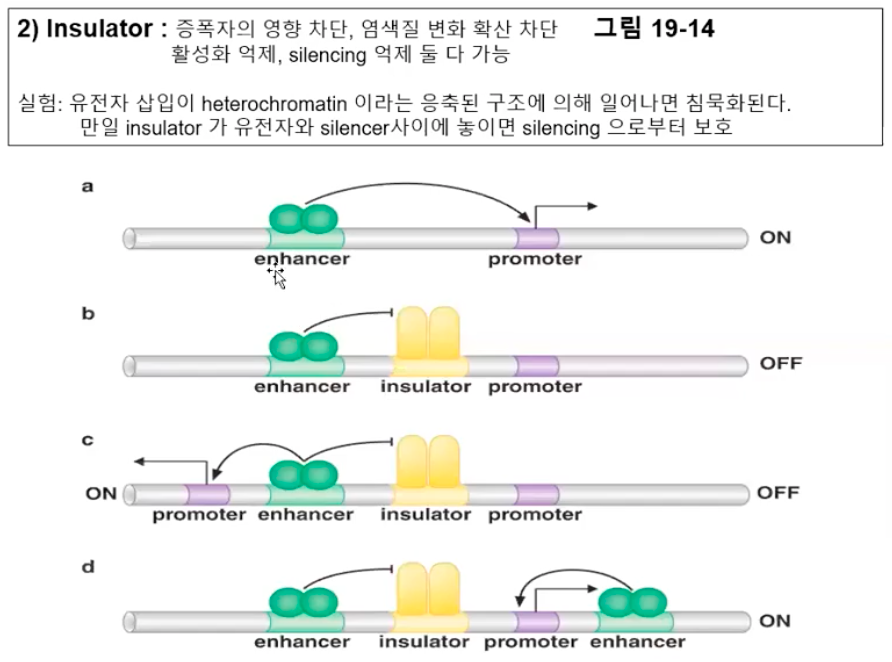
여기에는 전사를 촉진하는 증폭자 뿐만 아니라 전사를 억제하는 절연인자, 프로모터 부위 등이 혼재한다.
이 서열들의 적절한 조합에 의해 유전자의 발현이 조절되는데, 아마도 LCR의 활성 정도에 따라 염색질의 변화가 달라져 적절한 유전자가 발현되도록 전사를 유도하는 것으로 여겨진다.
(물론 여기에는 많은 모델이 있으나, 아직 특별히 지지되는 모델은 불분명하다)
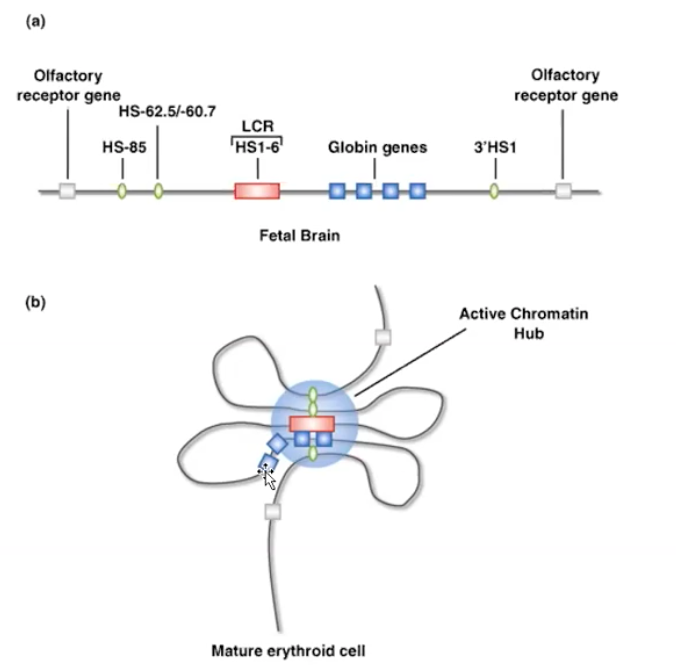

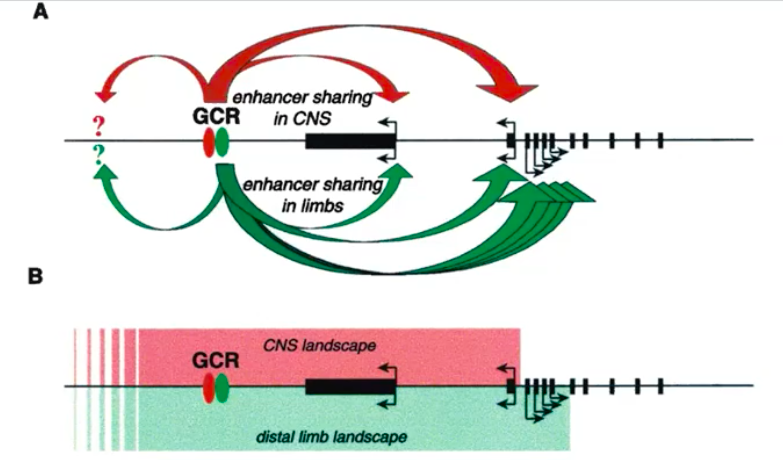
글로빈 유전자와 비슷한 것으로, 생쥐의 HoxD 유전자 집단이 있는데, HoxD 유전자들은 GCR(Global control region)이라는 인자에 의해 조절된다.
HoxD 유전자는 발생 과정에서 사지(팔다리)의 형성에 있어 매우 중요한 역할을 수행하는 단백질들을 만드는 유전자이며, 마찬가지로 GCR에 존재하는 여러 조절 서열의 조합에 따라 단백질 발현이 조절된다.
일반적으로 여러 활성인자들이 함께 작용할 때 시너지 효과가 발생하며 전사를 강하게 촉진하게 된다.
반대로 말하면, 하나의 억제인자가 활성인자를 저해하더라도 활성인자들의 효과는 크게 떨어져 전사가 억제될 수 있다는 뜻이기도 하다.
활성인자들의 시너지 효과는 활성인자들이 매개복합체와 어떻게 상호작용을 하는지 생각하면 쉽게 납득할 수 있다.
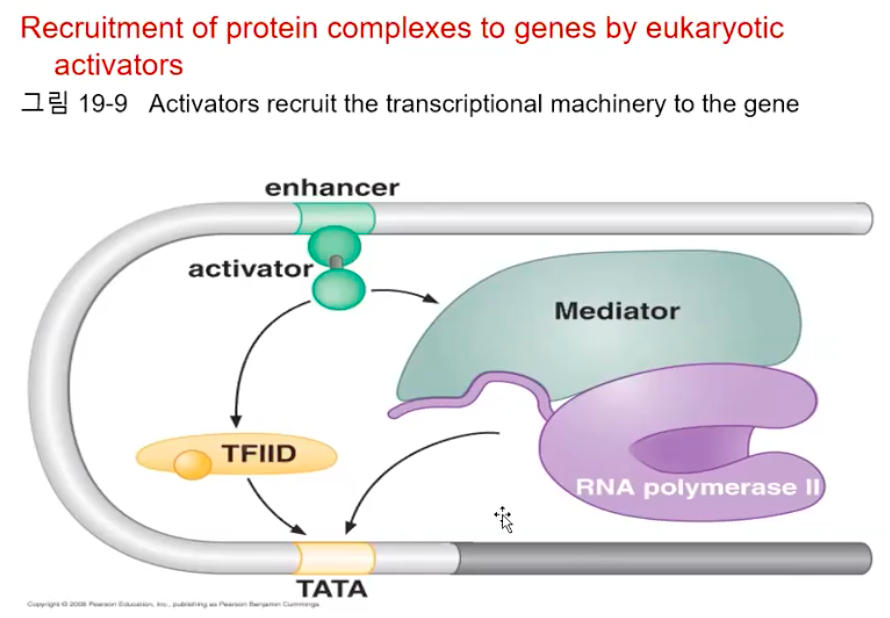
이제 활성인자와 전사 단백질들이 어떻게 상호작용을 하여 전사가 촉진되는가를 살펴보자.
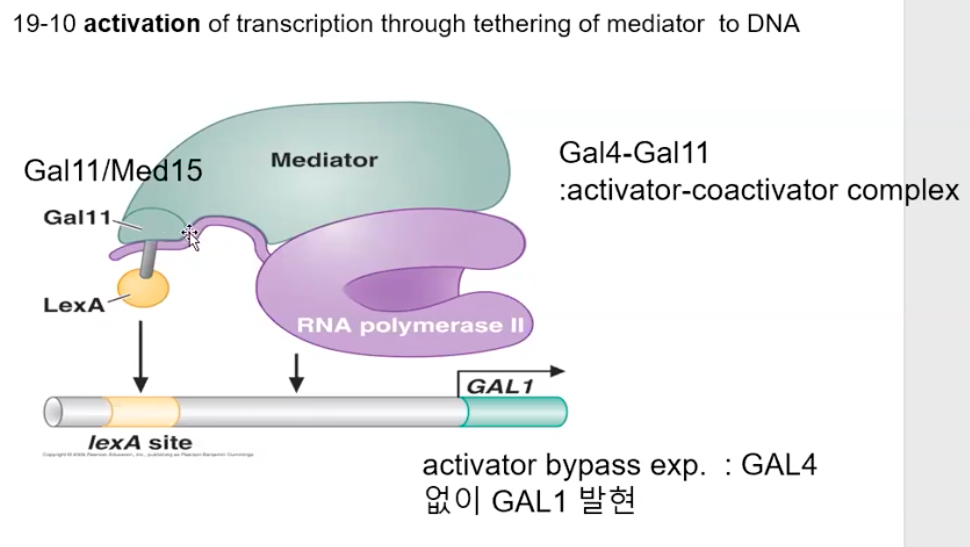
앞에서도 설명한 바와 같이, DNA에 결합한 활성인자들은 DNA 자체가 꼬이고 접혀 프로모터 근처의 매개복합체와 상호작용을 한다.
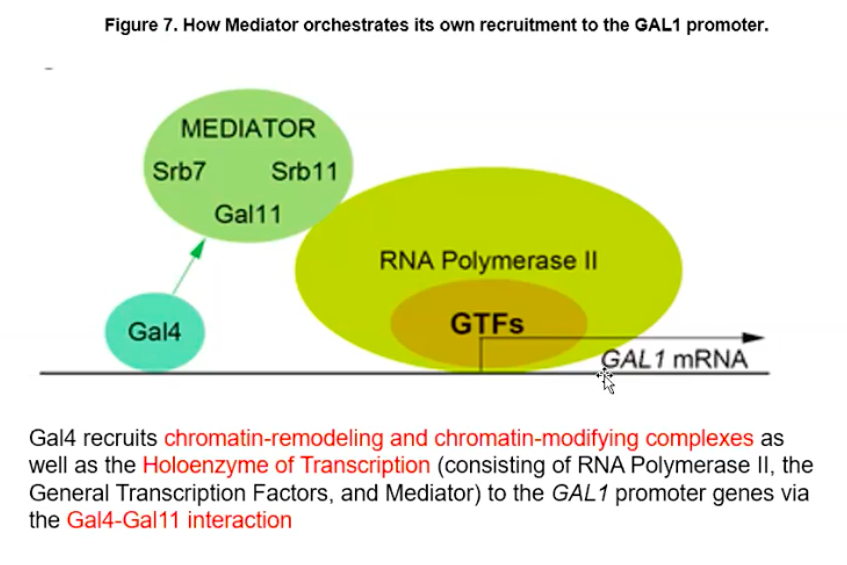
매개복합체는 거대한 복합체로, 전사 기구들과 직접 상호작용을 통해 잡아오거나, 또는 전사를 개시할 수 있도록 여러 단백질들을 프로모터 부위로 유인한다.
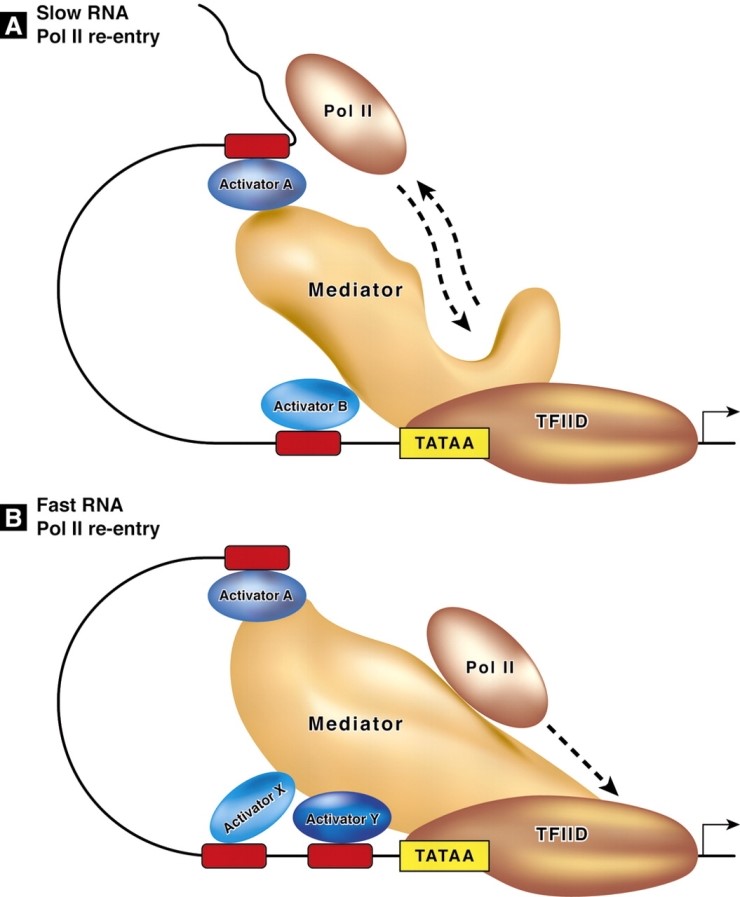
위 모식도에서처럼 매개복합체는 직접 PolⅡ(RNA polymeraseⅡ)를 유인한다.
그러나 어떤 활성인자들이 관여하는가에 따라 느리게 촉진되기도 하고(A), 빠르게 촉진되기도 한다(B).
여기에서 중요한 역할을 하는 단백질이 IHF(Integration host factor)단백질들인데, 이 녀석은 DNA를 구부리고 꼬이게 하여 멀리 떨어진 증폭자 서열이 프로모터 근처에 올 수 있도록 한다.
하나의 예로 초파리의 cut 유전자는 10만bp 정도나 떨어져 있는 증폭자에 의해 전사가 촉진된다.
증폭자와 프로모터 사이의 상호작용에 관여하는 단백질로 밝혀진 것이 Chip 이라는 단백질이다.
이 단백질에 대한 하나의 모델로, 증폭자와 프로모터 사이의 여러 DNA 결합부위에 결합하여 DNA에 작은 고리를 여러개 만들어 증폭자와 프로모터가 상호작용 할 수 있도록 하는 것으로 여겨진다.
또 다른 방법으로는, DNA를 구부리는 것이 아니라 염색질 자체를 구부리는 방법도 있을 수 있겠으나, 이 부분에 대해선 많이 알려진 바가 없다.
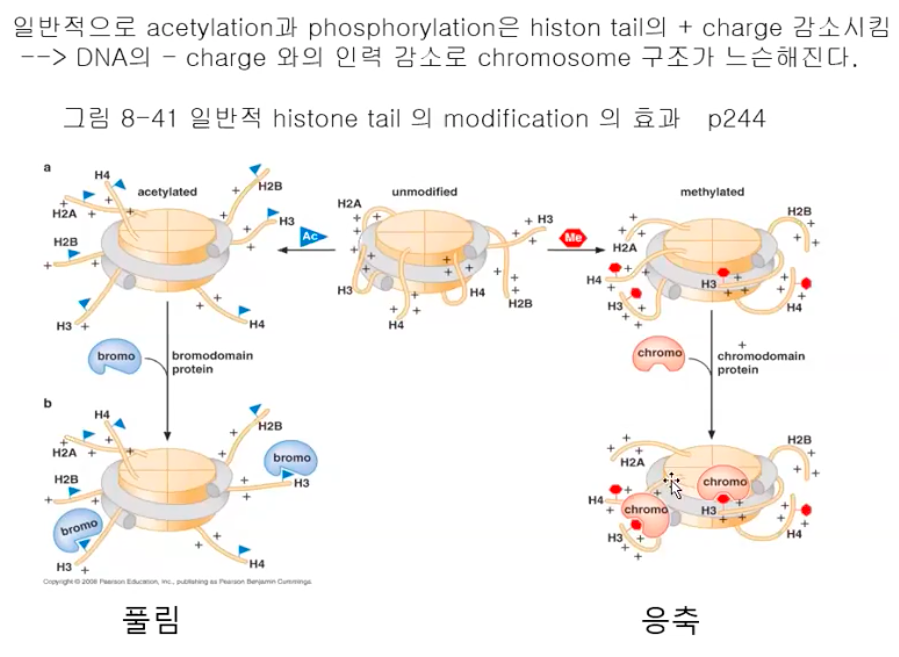
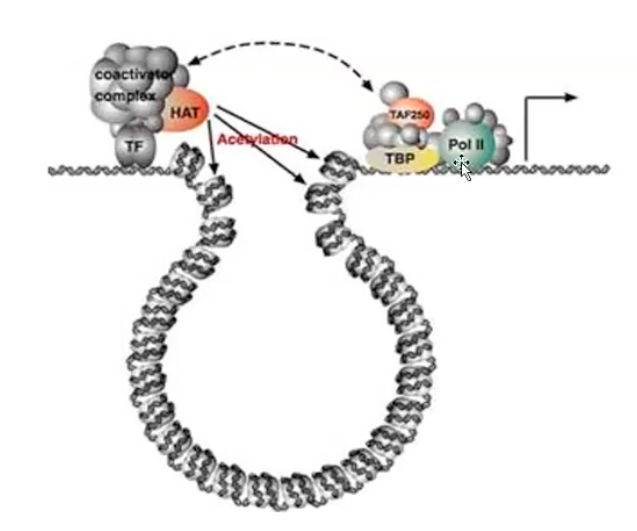
그러나 활성인자는 또 한 염색질의 구조를 변화시켜 전사를 촉진할 수 있는데, HATs이나 뉴클레오솜 변형효소들을 유인하여 염색질 구조를 푸는 것이다.
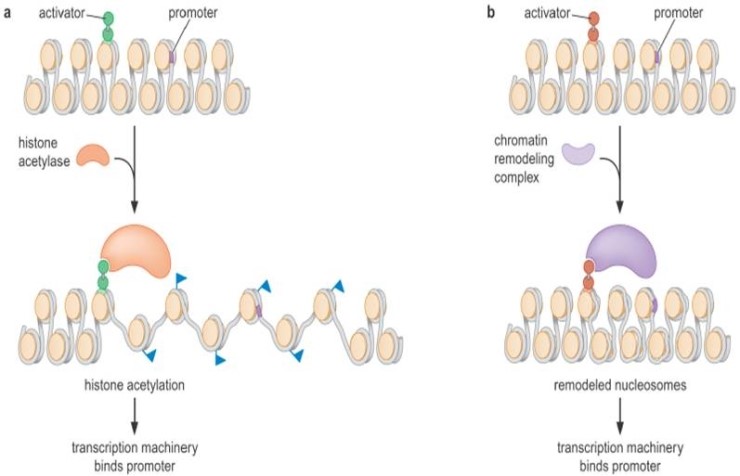
염색질의 구조가 풀리게 되거나 또는 뉴클레오솜이 리모델링되어 프로모터, 혹은 다른 조절부위가 노출되어 전사를 촉진한다는 것이다.
특히 히스톤에 아세틸기가 첨가되면 브로모도메인(Bromodomain)을 갖는 여러 단백질들이 결합할 수 있는데, 보편전사인자 중 하나인 TFⅡD는 아세틸화된 뉴클레오솜을 더 잘 인식하고 결합할 수 있다.
특히 염색질의 구조를 조절하는 이러한 단백질은 세포분열 때에 중요성이 더욱 커지게 되는데, 세포분열 때 DNA는 어떻게 되는가?
최대한 응축하여 현미경으로 볼 수 있을 정도가 된다. 그렇지만 이 상태에서도 어떤 유전자는 계속 발현이 되어야 할 것이다.
평소에는 HATs과 같은 히스톤 변형 효소가 없더라도 쉽게 발현이 되던 유전자라도 분열기에는 HATs과 같은 효소의 도움이 필요하다.
즉, 세포의 주기나 유전자의 종류에 따라 필요한 활성인자나 염색질 조절 단백질들의 조합이 달라질 수 있다.
활성인자들이 전사를 촉진하는 방법이 이것들 뿐일까? 다른 가능성도 생각해 볼 수 있다.
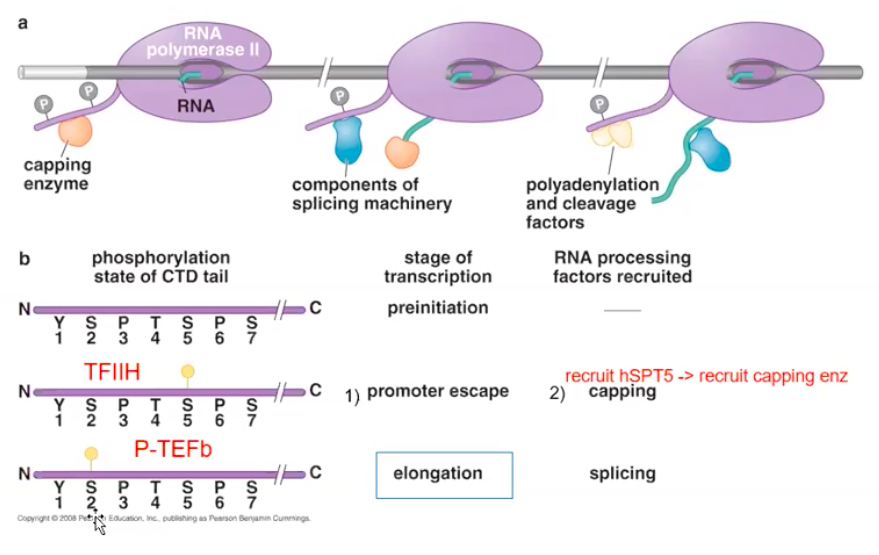
전사는 DNA의 복제보다 훨씬 불안정한 기전이다. 전사 도중에 RNA 중합효소는 종종 멋대로 DNA에서 떨어져버리거나, 멈춘다.
이런 문제를 줄이고 진행성을 향상시키는 단백질들에는 ELL계 신장인자나 TFⅡS와 같은 단백질과 같은 신장인자들이 있다.
이러한 신장인자들 역시 매개복합체가 유도할 수 있는데, 몇 가지 예를 살펴보자.
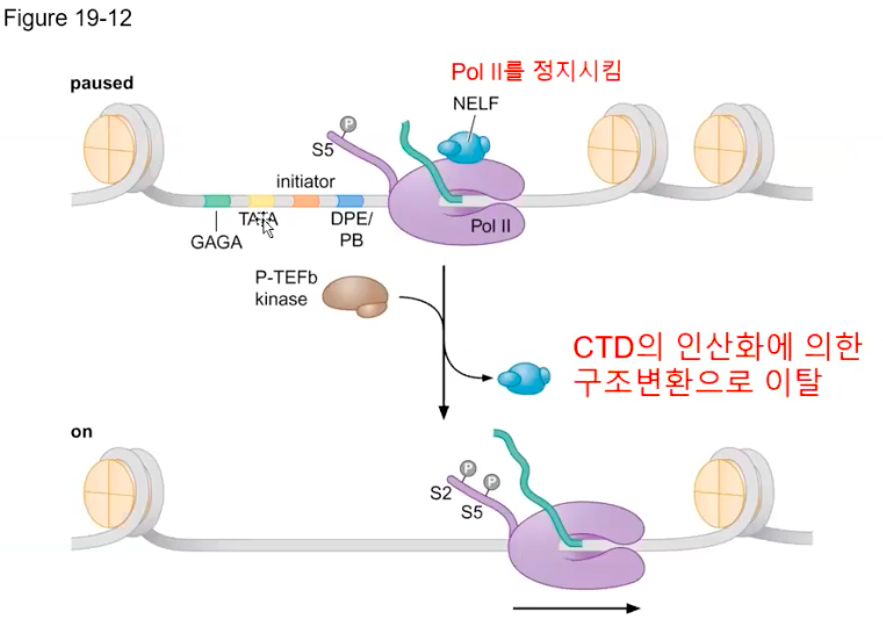
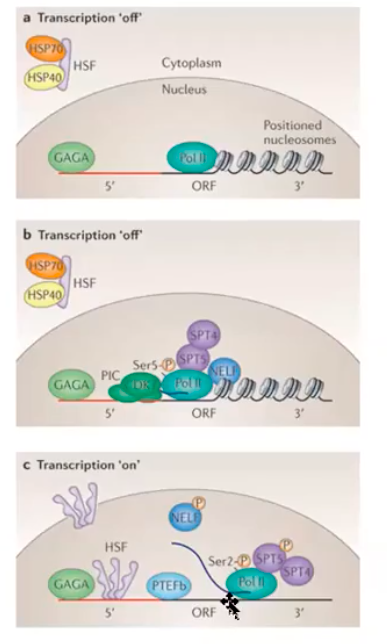
초파리의 HSP70 유전자는 GAGA 결합인자(GAGA-binding factor)라는 활성인자에 의해 전사가 촉진된다.
그러나 HSF라는 단백질이 없으면 프로모터 근처에서 전사를 멈추고 정지하게 되는데, HSF는 열충격이 있을 때 활성화되는 단백질이다.
HSF는 P-TEF라는 신장인자를 전사 기구들에 결합시키는데, P-TEF에 의해 RNA 중합효소의 C 말단 꼬리를 인산화시켜 정지한 지점부터 전사를 계속할 수 있게 된다.
(프로모터 탈출과 유사한 기전이라고 생각된다)
따라서, HSP70 유전자는 열 충격이 있을 때에만 활성화되는 유전자다.
이것과 유사한 것으로 HIV 역시 P-TEF가 전사 기구에 참여하지 않으면 중간에 전사가 멈추게 되는데, HIV는 RNA 개시 부위 근처의 서열을 인식하는 RNA 결합 단백질(TAT)를 이용한다.
만약 RNA 중합효소가 더 이상 전사를 지속하지 않고 정지한 상태라면 TAT과 RNA 중합효소가 상호작용을 할 수 있게 되고, 그 결과 P-TEF가 전사 기구에 참여할 수 있다.
'🧬 Bio > 분자생물학' 카테고리의 다른 글
| 분자생물학 (20) - Regulatory RNA (0) | 2020.12.10 |
|---|---|
| 분자생물학 (19.3) - DNA activation domain 2 (0) | 2020.12.08 |
| 분자생물학 (19.1) - Transcriptional regulation in eukaryotes (0) | 2020.12.07 |
| 분자생물학 (18) - Transcription factor (0) | 2020.12.06 |
| 분자생물학 (18) - Transcriptional regulation in prokaryotes 2 (0) | 2020.12.06 |