
1. Topoisomerase ll 는 딸 DNA 분자를 분리하는 데 필요하다.

염색체는 크게 2가지 형태이다.
대장균과 같은 Circular DNA 이다.
환형 DNA의 문제점은 복제하고 나서 고리로 엮이게 되는 것이다.
이 엮인 고리는 Topoisomerase ll 가 딸분자를 푼다.
Topoisomerase ll 는 이중가닥 DNA 분자를 절단해 이 절단된 틈으로 다른 이중가닥 DNA를 통과시키는 능력이 있다.
2. 선형 염색체의 말단에서는 지체가닥 합성이 불가능하다.
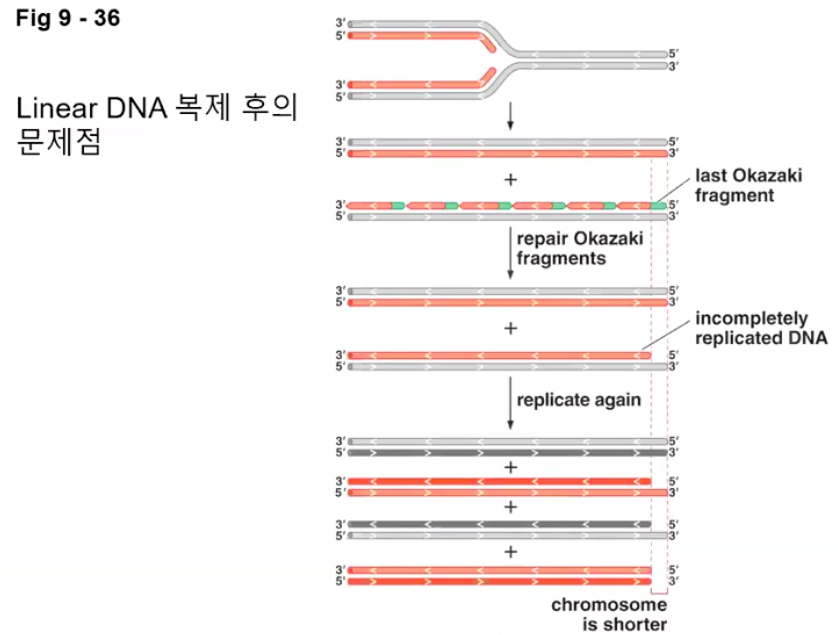
선형 DNA는 고리로 엮이지는 않는다.
헬리카아제가 복제분기점을 계속 풀면서 선도가닥은 쭉 풀지만
지체가닥은 계속 복제되면서 마지막 오카자키 조각의 맨 끝을 DNA로 채울 수 없다.
원래 뒤에 가닥의 3’에 붙여서 채웠지만 그럴 수가 없어서 점점 짧아진다.
그래서 복제를 진행할수록 말단이 짧아진다.
짧아진 것을 주형으로 하기 때문에 계속 짧아진다.
2.1. Priming protein
세포는 다양한 방법으로 말단 복제 문제를 해결한다. 한 가지 해결책은 염색체 각 말단에 있는 마지막 오카자키 조각의 프라이머로 RNA 대신 단백질을 사용하는 것이다. 이때 그 "프라이머 단백질"은 지체가닥의 주형에 결합하여, 원래 RNA 프라이머에 의해 제공되는 3'-OH를 대체하는 OH를 제공하는 아미노산을 사용한다.
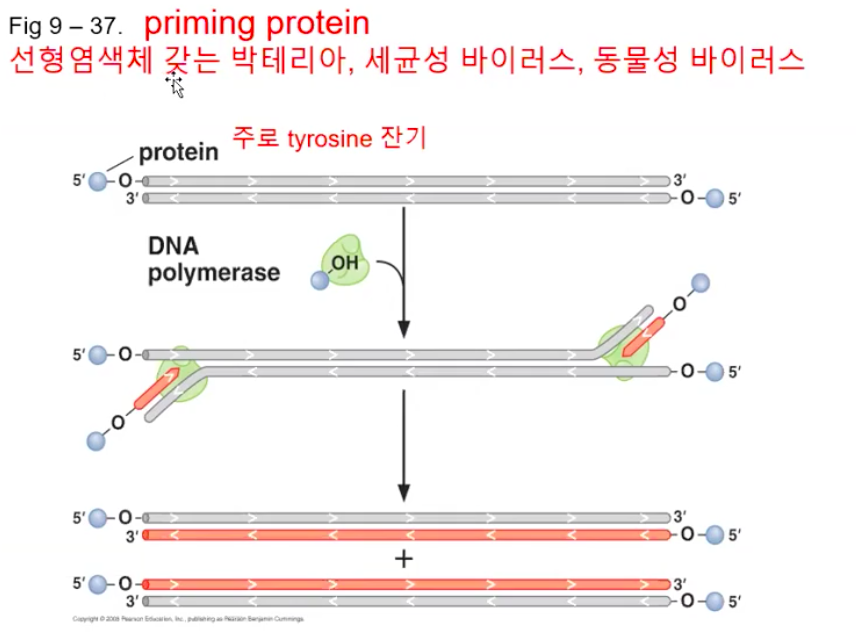
짧아진 가닥을 복구하는 기작
Priming protein이 OH를 제공하기 때문에 이것이 3’-OH 처럼 쓰일 수 있다.
그러면 여기에다가 DNA Polymerase가 하나씩 갖다 넣을 수 있다.
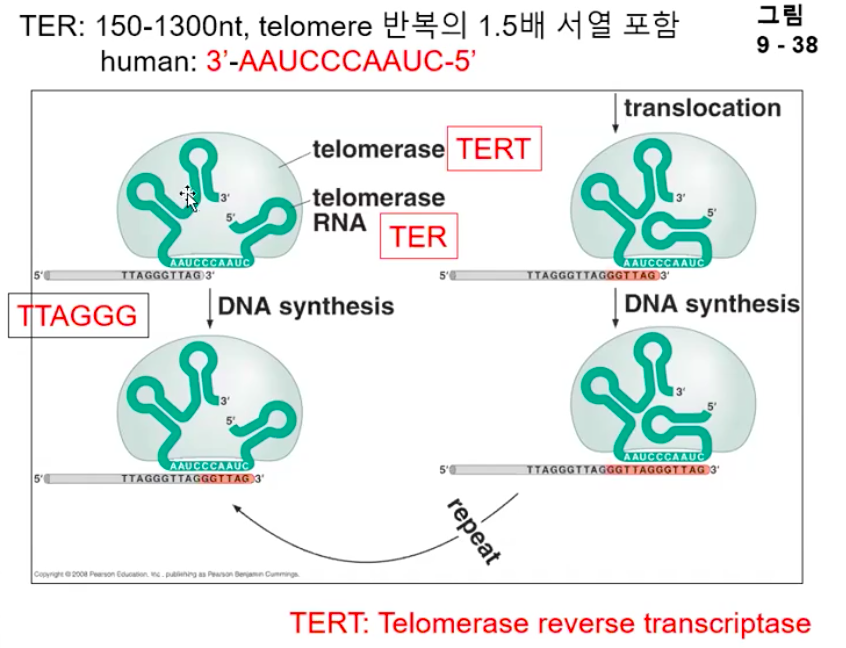
3. telomerase는 외래의 주형이 필요 없는 새로운 DNA 중합효소이다.


Telomerase는 자기 스스로 주형을 갖고 있는 DNA 중합효소이다.
즉 단백질과 RNA를 모두 가지고 있는 놀라운 효소이다.
다른 모든 DNA polymerase 처럼 Telomerase는 DNA의 3' 말단을 신장시키는 데 작용한다.
그러나 다른 DNA polymerase 와 다르게 DNA를 주형으로 필요로 하지 않는다.
자기자신의 RNA를 주형으로 사용한다.
4. telomerase는 염색체의 3' 말단을 신장시킴으로써 telomere 복제 문제를 해결한다.

텔로머라아제는 RNA를 주형으로 하는 DNA 중합효소 이다.
RNA 주형을 포함한다 (TER)
길이의 단위를 뉴클레오티드로 한 이유는 주형으로 하는 RNA가 단일가닥이기 때문이다.
이 RNA의 핵심 서열은 염색체의 말단인 텔로미어를 구성하는 반복서열의 1.5배를 포함한다.
인간 염색체 말단은 TTAGGGTTAGGGTTAGGG 로 반복되어 있는데
인간의 텔로머라아제 RNA 주형은 3’ AAUCCC AAU 5’ 정도이다.
텔로머라아제는 기본적으로 자기가 가지고 있는 RNA 주형을 원본으로해서 DNA를 합성하는 DNA 중합효소이지만, RNA를 주형으로해서 DNA를 합성하면 RNA-DNA double strand가 된다.
5. telomere 결합 단백질은 telomerase의 활성과 telomere 길이를 조절한다.

텔로미어 반복서열의 수가 비교적 적을 때에는, 적은 수의 단백질이 텔로미어에 거의 결합하지 않아 텔로머라아제는 텔로미어의 3'-OH 말단을 신장시킨다. 텔로미어가 길어짐에 따라 더 많은 텔로미어 결합 단백질들이 축적되어 텔로머라아제가 텔로미어의 3'-OH 말단을 신장시키는 것을 저해한다. 이 단순한 음성피드백 조절 기작(텔로미어가 길어질수록 텔로머라아제는 저해된다)은 모든 염색체 말단에서 텔로미어의 길이를 비슷하게 유지시키는 확실한 방법이다.
텔로머라아제는 이미 주형으로 쓸 수 있는 형태를 가지고 있다.
그리고 그 형태는 RNA의 형태이다.
TTAGGG 를 계속 붙임
선형의 염색체의 말단
복제하고 나서 말단에 생기는 문제점이 마지막 오카자키 조각에서 RNA를 제거하고 채울 수가 없기 때문에, Polymerase lll가 채울 수 없기 때문에 이것을 해결하는 것이 텔로머라아제이다.
이로써 염색체 말단이 짧아지지 않도록 복구할 수 있다.

정해진 횟수만큼의 세포분열을 하고 끝나게 되어있다. = Hayflick’s limit
세포분열 할 때마다 염색체 말단 즉 텔로미어가 짧아져 있었다.
이것으로 몇번 분열했는지 알 수 있다.
분화된 세포는 텔로머라아제 활성이 거의 없다.

텔로미어에 텔로머라아제가 결합해서 복구한다.
보통의 분화된 세포는 그런 능력이 없다.
또한 텔로미어 염색체 말단은 보통의 세포에서 중요한 역할을 한다.
텔로미어를 인식하는 많은 단백질들이 있다.
보통의 세포에는 짧아진 것을 복구하는 능력은 없지만 그것은 염색체를 보호하는 능력이다.
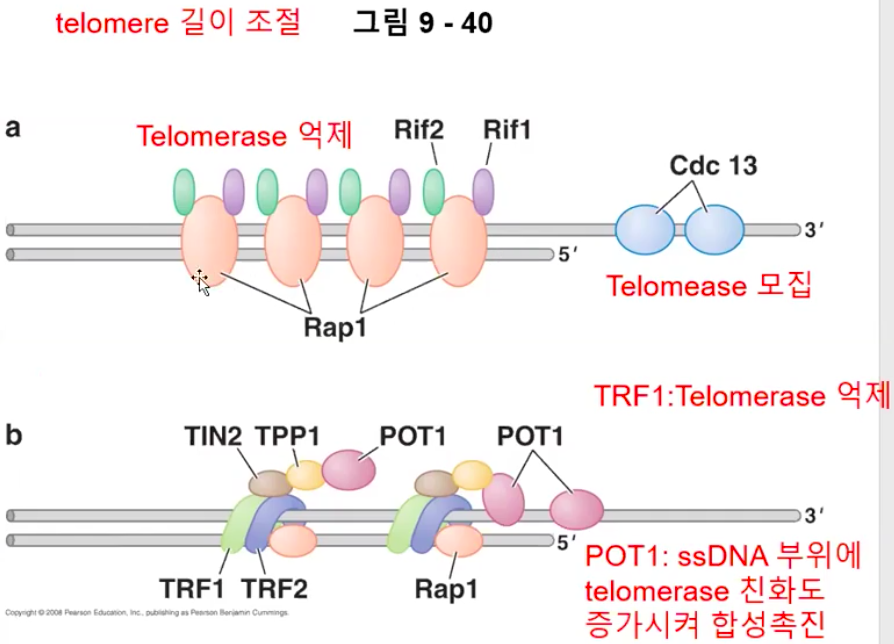
a. 단일가닥으로 있다면 Double strand 부분을 더 늘려야 하기 때문에 텔로머라아제를 더 모아와야 한다.
Cdc13 단백질은 텔로미어의 단일가닥 부분에 결합한다.
Cdc13 단백질은 텔로머라아제가 텔로미어에 집합하게 하는 역할을 한다.
따라서 Cdc13 단백질은 텔로머레이스의 양성적 활성자이다.
b. 단일가닥 텔로미어에 결합하는 단백질인 POT1은 반대로 작용하며 텔로머라아제 활성의 저해자 역할을 한다.
POT1은 텔로미어 활성을 방해한다.
텔로미어의 길이가 증가함에 따라 더 많은 POT1이 집합되고 텔로미어의 ssDNA 말단에 결합할 확률이 더 커져 텔로머라아제를 방해하는 것으로 여겨진다.
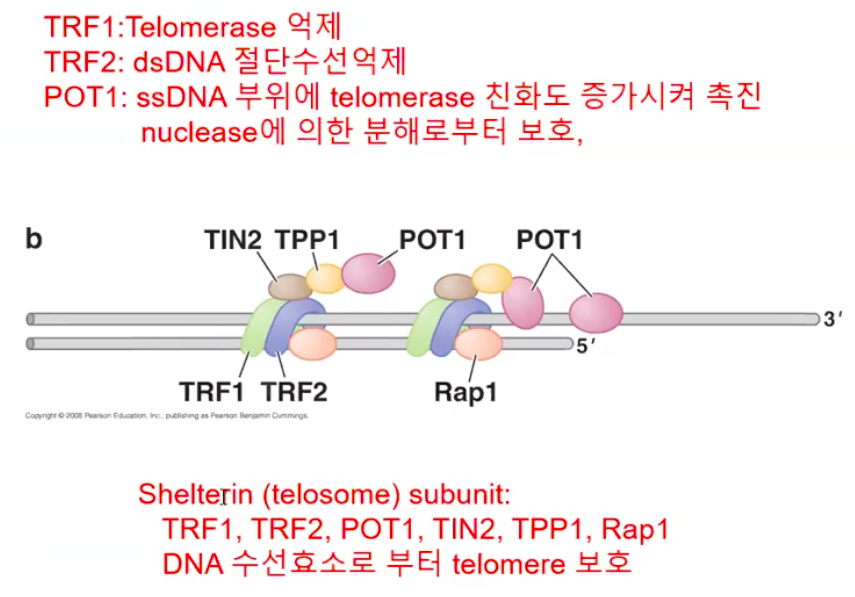
6. telomere 결합 단백질은 염색체 말단을 보호한다.
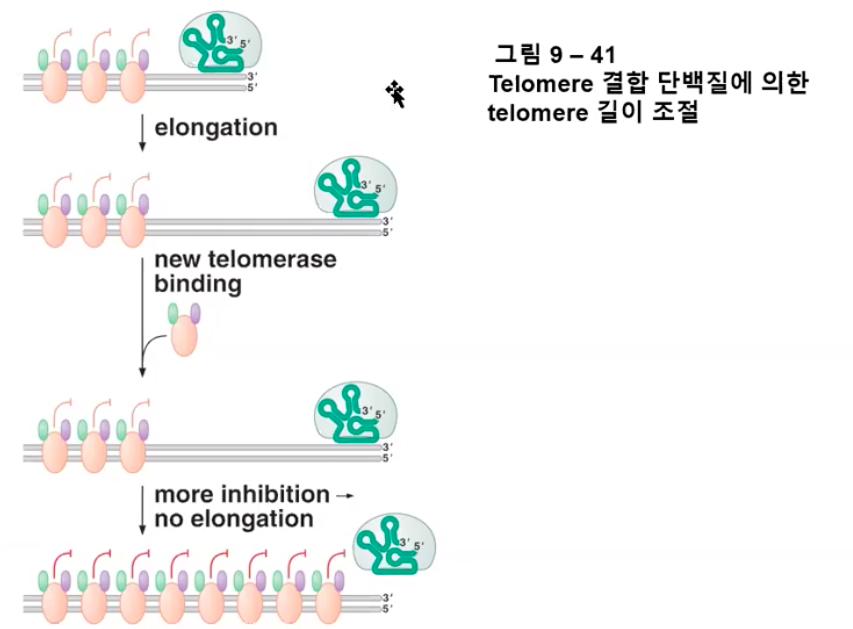
텔로미어 길이가 짧을 때 텔로미어 결합 단백질은 거의 나타나지 않아 텔로머라아제에 대한 저해가 약하다.
이러한 상황에서 텔로머라아제는 텔로미어의 3' 말단을 신장시킬 수 있다.
이 부위가 지체가닥 DNA 합성 기작에 의해 이중가닥이 되면 텔로미어 결합 단백질이 더 많아져 텔로미어에 결합하게 된다.
이들 단백질의 결합은 저해의 수준을 높여 텔로미어가 길어지는 것을 억제한다.
텔로미어를 복구하면 할수록 길어지고 더 많은 단백질이 결합하기 때문에
단백질들이 모이면 모일수록 복구할 필요가 없다. 즉 텔로미어를 억제한다.

말단소체 결합 단백질은 염색체 말단을 보호한다.
간단히 말해서 텔로미어에 결합된 단백질들이 세포 안의 다른 DNA 말단과 말단소체를 구별한다는 것이다.
이 단백질들을 제거하면 말단소체에 대한 인식이 일반적인 DNA 절단으로 인식이 된다.
보호는 단순히 말단소체가 결합 단백질로 덮어 씌워짐으로 이루어진다.
DNA 염색체는 여러가지 이유에 의해서 내부적이거나 외부적인 문제에 의해서 DNA가 절단될 수 있다.
잘라져서 생긴 염색체인가? 아니면 원래부터 말단인 염색체인가?
이를 알아볼 수 있는 표지가 있어야 한다.
6.1. t-loop

염색체의 말단을 안정하게 유지하는 것은 그 염색체의 구조적인 부분을 유지하는데에 중요하다.
수선기구가 와서 마구마구 붙이거나 절단하면 안된다.
염색체 말단은 사실 루프를 가지고 있다.
텔로미어 루프인 t-loop이다.

1. t-loop는 염색체 말단을 안정화시킨다.
수선효소에 의해 인지되지 않는다.
2. 길이가 충분하지 않으면 노출된 텔로미어에 의해서 염색체 말단을 늘리게 된다.
'🧬 Bio > 분자생물학' 카테고리의 다른 글
| 분자생물학 10장 (2) - DNA 손상 (0) | 2020.10.15 |
|---|---|
| 분자생물학 10장 (1) - 돌연변이와 mismatch repair (1) | 2020.10.11 |
| 분자생물학 9장 (3) - Sliding clamp, Clamp loader, DNA pol 3, Replisome (0) | 2020.10.10 |
| 분자생물학 9장 (2) - 복제분기점, Primase, Helicase, DNA polymerase (6) | 2020.10.10 |
| 분자생물학 9장 (1) - DNA 복제 (0) | 2020.10.04 |